INTRODUCERE
În ciuda progreselor înregistrate în tehnicile de diagnostic și chirurgicale și în îngrijirea postoperatorie, disecția aortică acută de tip A continuă să fie asociată cu o morbiditate și o mortalitate ridicată pe termen scurt și lung. Mortalitatea actuală în spital a fost estimată între 15% și 35%, cu o rată de supraviețuire la 5 ani de 65%-75%.1-7
Incidența ridicată a accidentului vascular cerebral postoperator la acești pacienți (10%-20%)3,5,7,8 a fost asociată cu o protecție cerebrală inadecvată în timpul stopului circulator, evenimente embolice sau malperfuzii datorate fluxului preferențial prin lumenul fals în timpul perfuziei cu ajutorul arterei femurale.9,10 În ultimii ani, introducerea de noi tehnici de protecție cerebrală, cum ar fi perfuzia cerebrală selectivă antegradă și canularea arterei axilare, a redus considerabil incidența acestei complicații.10-17
Scopul acestui studiu retrospectiv este de a descrie experiența noastră cu intervenția chirurgicală de disecție aortică acută de tip A – în raport cu mortalitatea spitalicească, incidența reintervenției și supraviețuirea pe termen lung – și de a analiza influența protecției cerebrale asupra rezultatelor noastre.
METODE
Între martie 1990 și octombrie 2007, 98 de pacienți consecutivi (79 de bărbați și 19 femei) au fost operați în spitalul nostru pentru disecție acută de tip A de aortă. Dintre pacienții diagnosticați și trimiși pentru intervenție chirurgicală (103) în această perioadă, 5 au fost excluși; 2 pacienți din cauza faptului că aveau peste 85 de ani, iar ceilalți pentru că prezentau leziuni cerebrale sau viscerale ireversibile.
Vârsta mediană a fost de 59 de ani. Cel mai frecvent simptom la prezentare a fost durerea toracică acută. Diagnosticul a fost confirmat prin aortografie în perioada inițială (18%), ecocardiografie transtoracică (76%), ecocardiografie transesofagiană (66%) și tomografie computerizată (CT) toracoabdominală (65%). Cu excepția a 11 pacienți, la care s-a efectuat un singur test de diagnosticare, toți pacienții au fost diagnosticați cu ajutorul a 2 sau 3 dintre aceste tehnici imagistice în combinație (în prezent, sistemul de diagnosticare utilizat este CT toracoabdominal cu sau fără ecocardiografie transtoracică și ecocardiografie transesofagiană intraoperatorie).
Un total de 91 (93%) de pacienți au fost supuși unei intervenții chirurgicale de urgență (în termen de 24 h), iar ceilalți au fost supuși unei intervenții chirurgicale de urgență (în cele 72 h de la diagnosticare).
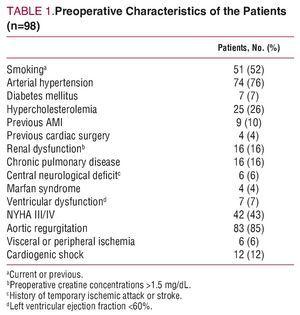
Testele imagistice au demonstrat regurgitarea aortică la 83 de pacienți (55% cu regurgitare severă). Caracteristicile clinice și demografice preoperatorii sunt prezentate în tabelul 1.
Tehnica chirurgicală
Conceptele de bază ale procedurii chirurgicale implică înlocuirea aortei ascendente sau a arcului aortic, rezecția rupturii primare și pregătirea anastomozei distale în timpul stopului circulator. În această perioadă de 18 ani, a existat o evoluție progresivă în strategia chirurgicală utilizată pentru această patologie. Inițial, doar aorta ascendentă era rezecată cu clampare aortică fără arest circulator. În 1994, a fost introdusă anastomoza distală cu oprire circulatorie, care este tehnica utilizată în prezent la toți pacienții, aplicându-se în același timp diferite metode de protecție cerebrală. Perfuzia cerebrală selectivă antegradă prin artera axilară a fost recent introdusă ca metodă de protecție cerebrală în timpul stopului circulator (figura 1).
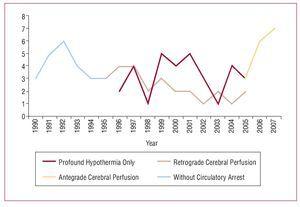
Figură 1. Evoluția strategiei chirurgicale.
Acesta a fost realizat prin sternotomie mediană, canularea arterei femurale (82%), canularea arterei axilare (16%) sau canularea arcului aortic (2%), cu întoarcere venoasă prin atriul drept (85%) sau vena femurală (15%) și bypass cardiopulmonar. Temperatura corpului a fost monitorizată prin esofag și vezică, iar hipotermia profundă a fost obținută atunci când temperatura vezicii urinare a ajuns la 18oC.
După clamparea aortică, aorta ascendentă a fost deschisă longitudinal și s-a efectuat o transecție supracoronariană pentru a localiza ruptura intimală, dacă există, și pentru a examina morfologia și funcționarea valvei aortice. Apoi, în hipotermie profundă și în stop circulator, aorta ascendentă a fost desfăcută și întregul arc aortic a fost examinat. La 27% dintre pacienți, s-a adăugat perfuzie cerebrală retrogradă prin vena cavă superioară (200-300 ml/min). La cei 16 pacienți la care s-a efectuat protecție cerebrală antegradă, s-a folosit artera axilară dreaptă (10-15 mL/kg/min), iar perfuzia selectivă s-a efectuat prin artera carotidă stângă la toți pacienții.
Lacrima primară a fost identificată la 83 de pacienți; aceasta a fost localizată în rădăcina aortică la 14%, în aorta ascendentă la 67% și în arcul aortic la 19% dintre pacienți. Segmentul aortic afectat de ruptura primară a fost rezecat și înlocuit cu o grefă de dacron Hemashield (Boston Scientific, Massachusetts, SUA) anastomizată cu sutură monofilament 4/0 continuă susținută de o bandă pericardică heterologă și consolidarea aortei native proximale și distale cu gelatină-resorcină-formaldehidă (GRF, adeziv biologic; Cardial Laboratories, Saint-Etienne, Franța). În timpul experienței noastre timpurii, înlocuirea segmentului aortic a fost efectuată utilizând tehnica de includere (acoperirea tubului protetic cu aorta nativă rezecată) la 21 de pacienți. În prezent, se folosește tehnica de interpoziție a grefei (înlocuirea prin proteză tubulară cu rezecția completă a aortei native).
Înlocuirea doar aortei ascendente a fost efectuată la 61 (63%) pacienți, extinsă la hemiarcadă la 24 (24%) și la arc aortic total la 13 (13%). Prin hemiarc, ne referim la cazurile de rezecție parțială a arcului, cu o anastomoză doar distală, fără a fi necesară reimplantarea trunchiului supraaortic. La 6 pacienți s-a folosit o trompă de elefant (în timpul înlocuirii totale a arcului aortic, un segment liber al tubului protetic rămâne în anastomoza distală atârnând în aorta toracică descendentă, ceea ce facilitează eventualele intervenții în această zonă). Valva aortică a fost cruțată prin resuspendarea comisurilor cu suturi monofilament 4/0 susținute de un plasture de teflon la 46 de pacienți (47%), înlocuită la 34 (35%) și reimplantată la 1 (1%). Atunci când a fost necesară înlocuirea valvei aortice, la 73% dintre pacienți acest lucru s-a făcut cu ajutorul unei grefe valvulare cu reimplantarea arterelor coronare prin tehnica Bentall. Starea preoperatorie a valvei aortice este descrisă în tabelul 2. După operație, în cazurile de resuspensie, competența valvulară a fost obiectivată prin ecocardiografie transesofagiană intraoperatorie la 84% dintre pacienți, regurgitare ușoară la 13% și regurgitare moderată (II/IV) la restul pacienților.

Timp mediu de bypass cardiopulmonar a fost de 183 (58) min, timpul de ischemie, 113 (39) min și timpul de stop circulator, 3 (23) min.
Un total de 24% dintre pacienți, cuprinzând experiența inițială, nu au fost supuși stopului circulator. La restul pacienților, metoda de protecție cerebrală utilizată a fost hipotermia profundă doar la 32 (33%) pacienți, perfuzia cerebrală retrogradă a fost adăugată la 26 (27%) pacienți, iar perfuzia antegradă la ceilalți 16 (16%).
Urmărire
Toți pacienții supraviețuitori au fost supuși la controale clinice și ecocardiografice anuale, precum și la examinări CT seriale pentru evaluarea aortei distale. Datele clinice au fost obținute prin interviuri personale și telefonice cu pacienții, membrii familiei și medicii de îngrijire primară. S-a obținut o rată de urmărire de 95% (79 de pacienți).
Analiză statistică
Programul statistic SPSS (versiunea 14.0 pentru Windows) a fost utilizat în toate analizele. A fost efectuată o analiză univariată a variabilelor perioperatorii pentru a determina factorii de risc semnificativi din punct de vedere statistic (P
REZULTATE
Mortalitatea spitalicească
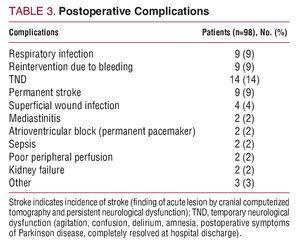
Mortalitatea spitalicească a fost de 15% (15/98): 6 pacienți au decedat din cauza sângerării intraoperatorii; 3, debit cardiac scăzut; 2, leziuni neurologice; 2, sepsis; și 2 din cauza insuficienței multiorganice postoperatorii. Tabelul 3 prezintă complicațiile postoperatorii.
Analiza univariată a arătat că vârsta înaintată, disfuncția ventriculară stângă, șocul cardiogen, timpul de bypass cardiopulmonar >200 min, timpul de clampare aortică >130 min și accidentul vascular cerebral postoperator au fost factori de risc pentru mortalitatea spitalicească (tabelul 4). Aceste variabile au fost supuse unei analize multivariate care a arătat că vârsta înaintată (≥70 de ani) (RR=2,85; P=.04) și șocul cardiogen preoperator (RR=2,6; P=.025) au fost identificate ca factori predictivi independenți ai mortalității spitalicești.

Disfuncția neurologică preoperatorie și primii ani de experiență (1990-1994) au fost singurele variabile care au fost asociate cu complicațiile neurologice postoperatorii (tabelul 4) în analiza univariată, dar acestea nu au atins semnificația statistică în analiza multivariată.
Mortalitatea și complicațiile neurologice postoperatorii specifice (accident vascular cerebral permanent și disfuncție neurologică temporară ) au fost măsurate în rândul pacienților care au fost supuși stopului circulator și a celor care nu au fost supuși stopului circulator și au fost stratificate în funcție de metoda de protecție cerebrală utilizată (hipotermie profundă singură sau în combinație cu perfuzie retrogradă sau antegradă) (Tabelul 5). Nu s-au constatat diferențe semnificative din punct de vedere statistic între niciunul dintre aceștia.

Urmărire
A fost obținută o rată de urmărire de 95% (79 de pacienți), cu o mediană de 61 (interval, 1-204) luni. După externarea din spital, toți pacienții au fost supuși unei examinări ecocardiografice la 2 luni și apoi anual. Un total de 67% (56/83) dintre pacienți au fost supuși la cel puțin 1 examinare CT. Dintre cei 27 de pacienți supraviețuitori care nu au fost supuși tomografiei computerizate, 17 au refuzat testul sau nu s-au prezentat, 4 au fost pierduți din studiu și 6 au decedat în timpul urmăririi, dintre care 1 din cauza unei cauze aortice cunoscute (ruptură de anevrism aortic abdominal).
Tomografia computerizată a evidențiat persistența unui lumen fals patent în aorta distală la 71% dintre pacienți, dintre care 17% au prezentat o dilatare progresivă a aortei toracice și a aortei abdominale.
Reintervenție
În total, 13 (16%) pacienți au fost supuși unei reintervenții în timpul urmăririi. Cauzele au fost următoarele: regurgitare aortică severă și dilatare a rădăcinii aortice la 5 pacienți, regurgitare aortică severă și redisecție a rădăcinii aortice la 3 pacienți, regurgitare aortică severă doar la 1, regurgitare aortică și mitrală severă la 1, endocardită mitrală și valvă aortică la 1, pseudoanevrism aorto-traheal la 1 și o fistulă între rădăcina aortică și atriul drept la 1. Niciun pacient nu a fost supus unei reintervenții pentru afecțiuni ale aortei descendente. Procedurile chirurgicale aplicate sunt prezentate în tabelul 6. Mortalitatea spitalicească a fost de 23% (3/13), 2 pacienți au decedat din cauza sângerării intraoperatorii și 1 din cauza debitului cardiac scăzut.
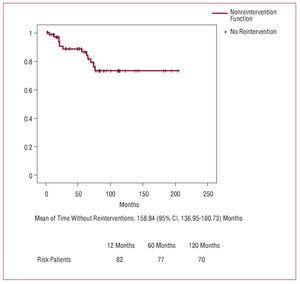
Figura 2. Curba non-reintervenției
Supraviețuirea pe termen lung
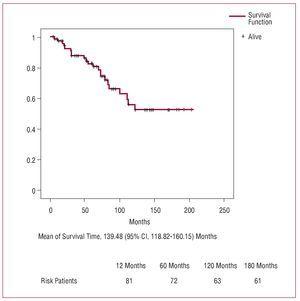
Figura 3. Curba de supraviețuire în timpul urmăririi (Kaplan-Meier).

Analiza univariată a arătat ca predictori ai mortalității în timpul urmăririi vârsta înaintată (≥70 de ani), tehnica de includere, TND postoperatorie și aplicarea metodelor de protecție cerebrală neantegrată (tabelul 9). În analiza multivariată, singurul predictor independent semnificativ din punct de vedere statistic al mortalității în timpul urmăririi a fost neutilizarea protecției cerebrale antegrade (RR=3,1; P=,02).

DISCUȚII
Disecția aortică acută de tip A este o situație critică care necesită un răspuns clinic imediat și o intervenție chirurgicală de urgență în majoritatea cazurilor.
Siegal et al18 au estimat că, la pacienții netratați, riscul de mortalitate crește cu 1% la fiecare oră în primele 48 h și ajunge la 70% după 1 săptămână. Conform datelor din International Registry of Acute Aortic Syndrome (IRAD),1 mortalitatea în rândul pacienților tratați conservator este de 58% față de mortalitatea chirurgicală totală de 24%.
Deși în ultimii ani s-au făcut progrese mari în tehnicile diagnostice și chirurgicale și în îngrijirea postoperatorie, există o variabilitate considerabilă în ceea ce privește mortalitatea spitalicească, variind între 15 și 30%.2,3,19-21 În experiența noastră, mortalitatea spitalicească a fost de 15%, similară cu cele mai bune rezultate din seriile actuale.4,22
Predictorii mortalității spitalicești coincid cu cei din majoritatea seriilor publicate.2-4,21 Conform datelor din IRAD,1 variabilele independente ale mortalității sunt vârsta avansată, hipotensiunea/șocul, boala cardiacă anterioară și ischemia preoperatorie renală, mezenterică sau miocardică. Aceste rezultate arată că mortalitatea în spital este de obicei asociată cu caracteristicile clinice preoperatorii ale pacienților și care sunt dificil de modificat. Rampoldi et al1 au arătat că pacienții instabili au o rată de mortalitate chirurgicală care este cel puțin dublă față de cea a pacienților stabili (31,4% față de 16,7%). Aceste constatări relevă importanța stabilității hemodinamice preoperatorii și subliniază necesitatea unei intervenții chirurgicale de urgență înainte de apariția deteriorării hemodinamice.
În seria noastră, singurii predictori independenți ai mortalității spitalicești au fost vârsta înaintată (≥70 de ani) și șocul cardiogen preoperator.
E întinderea rezecției chirurgicale nu a fost identificată ca factor de risc independent al mortalității spitalicești; rezecțiile mai extinse cu înlocuirea arcului aortic nu au afectat rezultatele precoce sau tardive. Alți autori, pe de altă parte, au propus rezecția exclusivă a aortei ascendente, argumentând că riscul implicat de rezecțiile mai extinse depășește potențialul beneficiu și că scopul principal al intervenției chirurgicale este supraviețuirea pacientului.5
Cauza leziunilor neurologice în timpul intervenției chirurgicale pentru disecția aortică este multifactorială și poate duce la stop circulator prelungit, evenimente embolice și perfuzie cerebrală deficitară din cauza fluxului preferențial prin lumenul fals.
Complicațiile neurologice postoperatorii sunt o cauză frecventă de morbiditate și mortalitate în intervenția chirurgicală pentru disecția aortică, cu o incidență estimată de 10%-20%.3,5,7,8
Ergin et al9 și Hagl et al10 subliniază că accidentul vascular cerebral postoperator provoacă în principal evenimente embolice într-o posibilă asociere cu perfuzia retrogradă din artera femurală, dar nu direct cu metoda de protecție cerebrală utilizată, în timp ce TND ar fi asociată cu o protecție cerebrală inadecvată. Perfuzia cerebrală antegradă a fost asociată cu o reducere semnificativă a TND în serii recente,10,11,23,24 deși rolul său este mai puțin clar în ceea ce privește reducerea accidentului vascular cerebral.
Perfuzia cerebrală antegradă a modificat conceptul de stop circulator la acești pacienți deoarece, strict vorbind, nu se realizează un stop circulator total, având în vedere că perfuzia cerebrală continuă este menținută între 500 ml/min și 1000 ml/min. Mai mult, mai mulți autori au propus că hipotermia moderată (25oC) ar fi suficientă pentru a proteja creierul și a evita efectele nocive ale hipotermiei profunde.17,25,26 Cu toate acestea, grupul nostru a aplicat hipotermia profundă deoarece aceste reparații sunt complexe, se preconizează că vor fi de lungă durată și deoarece această metodă de răcire s-a dovedit a fi foarte eficientă în protejarea creierului, precum și a celorlalte organe.17,27,28
Canularea arterei axilare, în loc de cea femurală, reduce riscul de perfuzie viscerală și cerebrală deficitară, remobilizarea trombilor din aorta abdominală și toracică spre creier și, în plus, redirecționează fluxul spre adevăratul lumen, scade șansele acumulării unei presiuni excesive la clamparea aortei și facilitează restabilirea perfuziei distale antegrade.12-16 Toate aceste avantaje par să indice faptul că perfuzia cerebrală antegradă prin artera axilară, cu excepția cazului în care aceasta este afectată de ateroscleroză severă, este metoda de alegere pentru protecția cerebrală.10,11,17
În seria noastră, perfuzia cerebrală antegradă prin intermediul arterei axilare a redus incidența TND la 6% și mortalitatea spitalicească la 6% la ultimii 16 pacienți care au fost operați, sugerând, dar nu demonstrând, rolul său în protejarea împotriva complicațiilor neurologice și a morbidității și mortalității concomitente acestora. Posibil ca această lipsă de semnificație statistică să se datoreze numărului redus de intervenții care au utilizat perfuzia antegradă prin artera axilară. Având în vedere raritatea acestei intervenții (
La 10 ani, 73,3% dintre pacienți nu au fost supuși unei reintervenții, iar acest rezultat este similar cu cele publicate.3,4,6,29,30 Valva aortică a fost cruțată ori de câte ori a fost posibil și numai în cazurile de degenerare valvulară, ectasie anuloaortică sau cardiopatie valvulară anterioară s-a decis înlocuirea valvei singure sau cu înlocuirea rădăcinii aortice (tehnica Bentall), procedură care nu a modificat mortalitatea spitalicească.
În seria noastră, 77% dintre pacienții care au suferit reintervenție (13/78) au necesitat acest lucru din cauza regurgitării aortice severe care se prezentase anterior și fusese tratată conservator prin resuspendarea valvei în timpul intervenției inițiale. Regurgitarea aortică acută preoperatorie și cruțarea valvei aortice au fost tocmai factorii care au determinat reintervenția aortică târzie, iar acest lucru ar justifica un management agresiv al valvei aortice în timpul procedurii inițiale.6,29 Hagl et al31 au recomandat înlocuirea sistematică a rădăcinii și a valvei aortice (tehnica Bentall). Pe de altă parte, Estrera et al32 au raportat un nivel acceptabil de durabilitate după economisirea valvei aortice; ei au subliniat că o eventuală reintervenție nu ar trebui să dicteze procedura inițială și au recomandat economisirea valvei aortice pentru a evita terapia anticoagulantă cronică și posibilul rol al acesteia în absența trombozei lumenului fals33.
Considerăm că prezentarea inițială a regurgitării aortice severe determină o severitate mai mare a disecției, a cărei origine sau extensie include rădăcina aortică și, prin urmare, tratamentul agresiv cu rezecția rădăcinii aortice și a valvei aortice și implantarea unei grefe valvulare (tehnica Bentall) ar trebui să fie procedura de elecție.4,6,29,31 În aceste cazuri, resuspendarea valvei, prin cruțarea rădăcinii aortice, lasă în urmă un segment de aortă intrinsec bolnav care prezintă un risc mai mare de redisecție și complicații ulterioare. Rezultatele publicate privind tehnica de înlocuire a rădăcinii aortice cu reimplantarea valvei aortice (tehnica David) sunt promițătoare și, deși este necesară o evaluare pe termen lung, ar putea deveni o opțiune interesantă33,34.
Dintre cei 56 de pacienți care au supraviețuit externării din spital și care au fost supuși unui CT în timpul urmăririi, doar la 6 (11%) a fost evidentă dilatarea progresivă în alte regiuni ale aortei cu indicație chirurgicală: 2 pacienți cu anevrism de aortă abdominală, 2 cu anevrism toracoabdominal și 2 cu anevrism de aortă toracică descendentă. Dintre acești pacienți, 2 au refuzat reintervenția, iar ceilalți au avut anumite comorbidități (vârstă avansată, deficit neurologic sever etc.) care au făcut imposibilă procedura.
O rată atât de scăzută de reintervenție a aortei distale se datorează probabil procentului ridicat de rupturi primare ale intimului localizate în timpul intervenției și deciziei noastre de a le rezeca în toate cazurile. De fapt, dintre cei 15 pacienți la care ruptura intimă nu a fost găsită, 60% (9 pacienți) făceau parte din grupul care nu a fost supus stopului circulator (care împiedică examinarea arcului aortic și exclude rupturile intimale la acest nivel) și care a prezentat un risc crescut de reintervenție aproape de limitele semnificației statistice (P=.06). Astfel, mai mulți autori descriu lipsa rezecției rupturii intime în timpul intervenției chirurgicale inițiale ca fiind principalul factor implicat în reintervenția tardivă pentru dilatarea aortei toracice sau abdominale.6,30
Deși grupul nostru nu are experiență în acest sens, unii autori subliniază că, în cazuri date, implantarea unui stent în aorta toracică descendentă în timpul intervenției inițiale sau a doua ar putea îmbunătăți rezultatele prin scăderea incidenței reintervenției și a apariției complicațiilor datorate evoluției bolii către aorta distală.35,36
Curba de supraviețuire actuarială după externarea din spital indică niște procente comparabile cu cele descrise de alți autori.2,3,5,6 Vârsta înaintată este unul dintre factorii de risc independenți ai mortalității în timpul urmăririi în majoritatea seriilor, parțial din cauza speranței de viață scăzute la acest grup de pacienți.2 În general, există o mare variabilitate în determinarea predictorilor independenți ai supraviețuirii pe termen lung. Chiappini et al2 au descris o serie de 487 de pacienți care au fost supuși unei intervenții pentru disecția aortică de tip A și au constatat că singurul factor de risc a fost diabetul preoperator. Erwin și colab,3 într-un grup de 315 pacienți, au identificat vârsta avansată și dializa postoperatorie ca fiind factorii predictivi ai mortalității în timpul urmăririi.
În seria noastră, am constatat că neutilizarea protecției cerebrale antegrade a fost un factor predictiv al mortalității tardive, ceea ce indică faptul că, deși perfuzia antegradă nu a modificat semnificativ rezultatele postoperatorii inițiale, aceasta are o mare importanță în ceea ce privește supraviețuirea tardivă.
Ergin și colab.9 au asociat TND postoperatorie cu afectarea funcției cerebrale pe termen lung. Pompilio et al37 au evaluat influența evenimentelor neurologice perioperatorii asupra mortalității târzii, adică pacienții care au supraviețuit spitalizării din cauza leziunilor neurologice au avut rate de supraviețuire pe termen lung mai slabe. Acest fapt poate fi explicat prin riscul ridicat de bronhopneumonie, de noi evenimente neurologice și de alte complicații legate de capacitatea funcțională redusă a acestor pacienți.4
Limitări
Acest articol împărtășește toate limitările asociate cu studiile retrospective nerandomizate. Incidența scăzută a acestei afecțiuni înseamnă că puțini pacienți au fost supuși intervenției, limitând astfel puterea statistică a constatărilor.
Ca urmare a faptului că această analiză acoperă o perioadă lungă de experiență, primii pacienți, care au fost gestionați fără stop circulator, și cei mai târziu, care au fost gestionați cu perfuzie cerebrală antegradă, nu au fost contemporani cu celelalte metode de protecție cerebrală menționate. Ultima metodă (perfuzia cerebrală antegradă) a fost aplicată pe un eșantion de dimensiuni mici (16 pacienți), ceea ce limitează semnificația statistică a rezultatelor.
CONCLUZII
Chirurgia disecției acute de aortă produce rezultate acceptabile pe termen scurt și lung, iar intervenția de urgență ar trebui să fie indicată la majoritatea pacienților.
Regurgitarea aortică severă este asociată cu un risc ridicat de reintervenție precoce și acest lucru ar justifica un management agresiv al valvei aortice în timpul intervenției chirurgicale inițiale.
Perfuzia cerebrală antegradă a modificat conceptul de stop circulator și a îmbunătățit prognosticul pe termen lung în rândul acestor pacienți. Considerăm că, deși este necesară experiența unor serii mai extinse, aplicarea perfuziei cerebrale antegrade în chirurgia disecției acute de aortă ar putea îmbunătăți prognosticul în rândul acestor pacienți.
ABREVIERI
CT: tomografie computerizată
TND: disfuncție neurologică temporară
.