Structura Lewis a ionului oxalat este desenată în acest tutorial pas cu pas. Conceptul de electroni de valență totală este utilizat pentru a desena structura lewis a C2O42-. După ce se termină structura lewis a C2O42-, ar trebui să existe o sarcină -2 și o stabilitate. Veți învăța despre aceste lucruri în acest tutorial.
Ion oxalat | C2O42-
Ion carbonat are o sarcină -2. Există doi atomi de carbon în ionul oxalat.
C2O42- structura Lewis
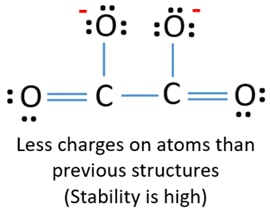
Doi atomi de carbon sunt uniți cu un atom de carbon. La fel, ceilalți doi atomi de oxigen sunt uniți cu alți atomi de carbon. În structura lewis a ionului C2O42-, ionul este simetric în jurul legăturii C-C.
Etapele de desenare a structurii lewis a ionului C2O42-
Pentru a desena structura lewis a ionului C2O42- sunt necesari următorii pași care sunt explicați în detaliu în acest tutorial.
- Căutați numărul total de electroni din straturile de valență ale atomilor de carbon și oxigen. Acest lucru este folosit pentru a determina numărul de legături, perechi de electroni singuratici din jurul atomilor.
- Total perechi de electroni din jurul atomilor
- Selecția atomului central în funcție de valența maximă
- Puneți perechile singuratice pe atomi
- Verificați stabilitatea și minimizați sarcinile pe atomi pentru a construi cea mai stabilă structură prin convertirea perechilor singuratice în legături.
Pe lângă acești pași, următoarele fapte sunt importante pentru a desena structura lewis.
Oxigenul ar trebui să dețină sarcini negative în structura lewis deoarece oxigenului îi place să păstreze electronii decât atomul de carbon.
Electronegativitatea oxigenului este mai mare decât cea a carbonului.
Desenarea corectă a structurii lewis este importantă pentru a desena corect structurile de rezonanță ale CO32-.
Numărul total de electroni din straturile de valență ale C2O42-
Carbonul este situat în grupa 4 din tabelul periodic. Așadar, carbonul are patru electroni în învelișul de valență. Oxigenul este situat în grupa a 6-a. Acesta are șase electroni în învelișul de valență.
- Total electroni de valență dați de atomul de carbon = 4 * 2 = 8
Există patru atomi de oxigen în ionul C2O42-, Prin urmare
- Total electroni de valență dați de atomii de oxigen = 6 *4 = 24
Ionul C2O42- are o sarcină de -2. Prin urmare, există încă doi electroni care contribuie la electronii de valență.
- Total electroni de valență = 8 + 24 + 2 = 34
Total perechi de electroni de valență
Total perechi de electroni de valență = legături σ + legături π + perechi solitare la nivelul învelișurilor de valență
Total perechi de electroni se determină prin împărțirea la doi a numărului total de electroni de valență. Pentru, ionul C2O42-, perechile totale de electroni sunt 17.
Actomul central al ionului C2O42-
Pentru a fi atomul central, este importantă capacitatea de a avea o valență mai mare. Carbonul are mai multe șanse de a fi atomul central (vezi figura) deoarece carbonul poate prezenta valența 4. Valența cea mai mare a oxigenului este 2. Deci, acum putem construi o schiță a ionului C2O42-.
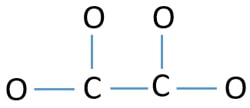
Perechi singure pe atomi
- În schița de mai sus există patru legături C-O și o legătură C-C, ceea ce face cinci legături. Prin urmare, au rămas doar douăsprezece (17-5 = 12) perechi de electroni de valență.
- În primul rând, marcați acele douăsprezece perechi de electroni de valență ca perechi solitare în atomi din exterior (pe atomii de oxigen). Un atom de oxigen va lua trei perechi de electroni solitari, urmând regula octală (atomul de oxigen nu poate păstra mai mult de opt electroni în învelișul său de valență).
- Pentru patru atomi de oxigen, se cheltuiesc douăsprezece perechi de electroni. Acum, nu mai sunt perechi singuratice de marcat pe atomii de carbon după ce am marcat perechile singuratice pe atomii de oxigen (în afara atomilor).
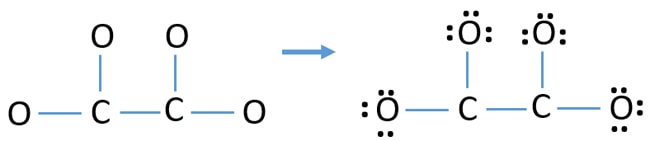
Cărțile pe atomi
După, marcarea perechilor de electroni pe atomi (în acest caz, doar pe atomii de oxigen), trebuie să marcăm sarcinile fiecărui atom, dacă există o sarcină. Marcarea sarcinilor este importantă deoarece este folosită pentru a determina cea mai bună structură lewis a ionului. După marcarea sarcinilor, veți vedea, fiecare atom de oxigen va primi o sarcină -1 și ambii atomi de carbon vor primi o sarcină +1.
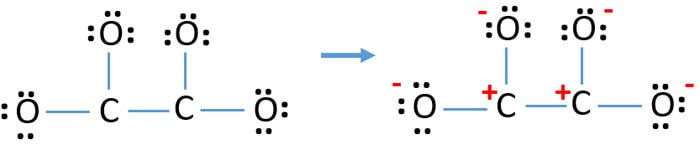
Această structură este foarte instabilă deoarece există sarcini peste tot în ion.
Verificați stabilitatea și minimizați sarcinile pe atomi prin transformarea perechilor singuratice în legături
- Atomii de oxigen trebuie să dețină sarcini negative deoarece electronegativitatea atomului de oxigen este mai mare decât cea a atomului de carbon. Altfel, putem spune că abilitatea de a reține sarcini negative este mai mare la atomii de oxigen decât la atomii de carbon.
- Structura desenată nu este una stabilă deoarece toți atomii au o sarcină (structura Lewis ar trebui să fie una stabilă cu mai puține sarcini).
- Acum, ar trebui să încercăm să minimizăm sarcinile prin convertirea perechii sau perechilor singuratice în legături. Deci, să convertim o pereche singuratică a unui atom de oxigen pentru a face o legătură C-O.
- Acum există o legătură dublă între un atom de carbon și un atom de oxigen (o legătură C=O). Acum, există trei legături simple între atomul de carbon și ceilalți trei atomi de oxigen (două legături C-O).
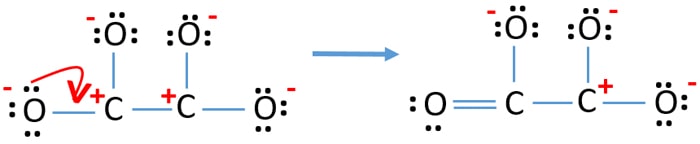
În noua structură, sarcinile atomilor sunt reduse față de structura anterioară. Acum nu mai există sarcini pe un atom de oxigen și pe un atom de carbon. Dar, există încă sarcini pe trei atomi de oxigen (au -1 sarcină negativă) și pe celălalt atom de carbon. Acum înțelegeți că această structură a C2O42- este mai stabilă decât structura anterioară. Dar, încercăm să reducem sarcinile cât mai mult posibil.
Reduceți sarcinile în continuare
Puteți converti perechea solitară a unui alt atom de oxigen într-o legătură C-O, așa cum se arată mai jos.
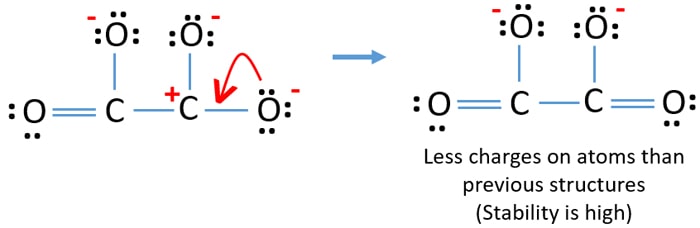
Structura lewis a ionului C2O42- (carbonat)
Întrebări
Puneți întrebările dumneavoastră de chimie și găsiți răspunsurile
Tutoriale conexe
.