Abstract
Scopul acestui studiu, care se concentrează pe un număr mic de cazuri, este de a aborda angiosarcomul de sân, care reprezintă mai puțin de 1% din toate tumorile de țesut moale ale sânului, și de a împărtăși în final experiența noastră. Ca o consecință a terapiei de conservare a sânului (BCT), care este tratamentul standard în zilele noastre, a fost evidențiat un nou tip de angiosarcom: Angiosarcomul indus de radiații (RIAS).
Aici este raportată o analiză retrospectivă a trăsăturilor caracteristice ale pacienților cu RIAS, împreună cu o relatare a tratamentului integrat și a rezultatului a șase cazuri de RIAS tratate în instituția noastră din 2013 până în 2018.
Angiosarcomul mamar ca o consecință a intervenției chirurgicale și a radioterapiei a fost rar înregistrat, dar este o complicație documentată a radioterapiei pentru cancerul de sân, cu o rată ridicată de recurență și rezultate slabe.
Rămâne o provocare din punct de vedere clinic, radiologic și histologic și, prin urmare, este necesar un indice ridicat de suspiciune la pacienții susceptibili. Mastectomia simplă este opțiunea principală de tratament, însă se concentrează un număr tot mai mare de studii privind utilizarea radioterapiei și chimioterapiei, fiecare cu un grad variabil de succes. Re-iradierea poate fi luată în considerare pentru a crește controlul local, în timp ce chimioterapia poate fi luată în considerare pentru cazurile aflate într-un stadiu mai avansat.
Abbreviație
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Imagistică prin rezonanță magnetică; IMRT: Radioterapie cu intensitate modulată
Keywords
Angiosarcom mamar (AS), Angiosarcom indus de radiații (RIAS), Mastectomie radicală (RM), Tumori induse de radiații, Radioterapie adjuvantă, Radioterapia cu intensitate modulată (IMRT)
Introducere
În această lucrare se discută diagnosticul, managementul și rezultatul RIAS la un număr mic de pacienți cu cancer de sân.
Ca o tumoare vasculară foarte rară, angiosarcomul mamar (AS) poate fi împărțit în primar, dacă apare fără un precursor cunoscut, sau secundar, dacă apare la nivelul pielii iradiate anterior, caz în care este cunoscut sub numele de Angiosarcom de sân indus de radiații (RIAS) . Dar, în continuare, nu există orientări bazate pe dovezi cu privire la tratamentul ideal al angiosarcoamelor.
La acele paciente care sunt supuse unei operații de conservare a sânului cu radioterapie adjuvantă, incidența estimată a RIAS variază între 0,05 și 0,3%, reprezentând mai puțin de 1% din tumorile mamare și aproximativ aproximativ aproximativ 3% din toate sarcoamele țesuturilor moi.
Incidența RIAS pare să fie în creștere, reflectând probabil perioada lungă de latență pentru dezvoltarea acestor tumori în urma adoptării pe scară largă a radioterapiei adjuvante pentru cancerul mamar.
Diagnosticul RIAS al sânului este adesea întârziat din cauza aspectului său benign și a dificultății de a-l diferenția de modificările cutanate nespecifice induse de o iradiere anterioară sau de o altă boală . Constatările radiologice sunt, de asemenea, adesea nespecifice. Deși RIAS se dezvoltă de obicei la 10 ani după radioterapia pentru cancerul de sân, perioada de latență poate varia de la 6 luni la 20 de ani , ceea ce îi determină pe unii autori să creadă că este probabil subraportat și că, prin urmare, ratele reale de incidență sunt mai mari. Pe măsură ce incidența cancerului de sân este în creștere, utilizarea chirurgiei conservatoare a sânului urmată de radioterapie a înlocuit mastectomia radicală ca tratament standard. Incidența asociată a RIAS este, de asemenea, în creștere, cu o incidență cumulată estimată de 0,9-3,2 la 1000 de cazuri de cancer de sân . Într-un amplu studiu de cohortă bazat pe populație, un istoric de radioterapie anterioară ca tratament pentru cancerul de sân a fost asociat cu o creștere de 26 de ori a riscului de a dezvolta angiosarcom, în comparație cu grupurile de control neiradiate . Prognosticul pacienților cu RIAS rămâne slab, cu rate de supraviețuire generală la 5 ani care variază între 27 și 48%. În ciuda faptului că RIAS a fost descris pentru prima dată la începutul anilor 1920, biologia sa moleculară este încă controversată și, prin urmare, nu există o terapie țintită disponibilă.
În prezent, rezecția chirurgicală agresivă este în mod obișnuit susținută ca tratament de elecție. Există o lipsă de date care să dovedească eficacitatea chimioterapiei adjuvante .
O intervenție chirurgicală, sub forma exciziei largi sau a mastectomiei, este pilonul de bază al tratamentului în cazul bolii localizate. Unele studii au raportat o asociere între marjele R0 și îmbunătățirea ratei de supraviețuire, deși nu s-a demonstrat că aceasta este independentă de alți factori biologici, cum ar fi dimensiunea tumorii . Există unele dovezi că chimioterapia neoadjuvantă poate îmbunătăți rezultatele în tratamentul angiosarcomului, a cărui raritate limitează cunoștințele noastre la rapoarte de caz sau la mici serii retrospective de cazuri .
Pentru a caracteriza o populație de pacienți cu RIAS, tratați în spitalul nostru pe o perioadă de 5 ani, am realizat un studiu retrospectiv care a analizat utilitatea mamografiei, ecografiei și imagisticii prin rezonanță magnetică (IRM) pentru diagnosticul nostru .
Lucrarea noastră a fost raportată în conformitate cu criteriile SCARE .
Materiale și metode
Seria noastră de cazuri privește pacienții cu angiosarcom de sân dovedit histologic, dezvoltat după radioterapie pentru cancer de sân, între 2013 și 2018, și analizează strategiile de tratament cu o abordare multidisciplinară.
Pacienții afectați, șase femei cu angiosarcom de sân indus de radiații, au fost identificați printr-o căutare cuprinzătoare în perioada menționată mai sus a registrului de cancer al instituției noastre, la Spitalul Universitar din Catania. Vârsta medie a fost de 70 de ani, interval: 59-79 de ani. Pacientele au efectuat managementul diagnostic și terapeutic anterior la diferite instituții, astfel încât informațiile nu sunt toate disponibile. Descrierea caracteristicilor pacienților și a procedurilor de tratament efectuate după diagnosticul RIAS sunt descrise în tabelul 1. Toate pacientele au fost supuse unui tratament conservator al sânului în momentul diagnosticului, cu radioterapie adjuvantă administrată prin radioterapie convențională conformațională tridimensională la o doză totală de 50 Gy, cu fracționare zilnică de 2 Gy, cu sau fără un boost de 10 Gy în patul tumoral. Tumorile au fost de partea dreaptă la 3 pacienți, iar la ceilalți 3 de partea stângă. În timpul tratamentului adjuvant, cinci din cele șase paciente au primit chimioterapie sistemică pe bază de antracicline, în conformitate cu orientările instituționale, în timp ce toate pacientele au primit terapie hormonală adjuvantă cu tamoxifen/inhibitor de aromatază. Nicio pacientă nu a avut cancer HER2-pozitiv la momentul diagnosticului.
În timpul urmăririi, după o perioadă mediană de 7,6 ani (interval: 5-11 ani), s-a efectuat diagnosticul de angiosarcom mamar ipsilateral: semnele cel mai frecvent prezentate de paciente la debut au fost noduli cutanați de culoare roșie-violetă, localizați în contextul câmpurilor de iradiere, cu o rată de creștere moderat variabilă, de la câteva săptămâni la 4-6 luni. Toate pacientele au primit o confirmare histologică a angiosarcomului secundar și în toate cazurile s-a efectuat o mastectomie radicală. Pentru diagnosticarea RIAS, au fost respectate criteriile Cahan și Arlen : sarcom apărut în cadrul câmpului iradiat anterior; o perioadă de latență de cel puțin 3 ani între radioterapie și apariția sarcomului; și o distincție histologică între sarcomul secundar și neoplasmul primar. Toate cele șase paciente au beneficiat de un bilanț radiologic complet cu mamografie, ecografie și RMN (la 4/6 paciente) în încercarea de a confirma suspiciunea clinică de RIAS, dar nu au fost identificate caracteristici patognomonice. Interesul din ce în ce mai mare al literaturii științifice pentru identificarea caracteristicilor specifice ale „semnăturii de radiație” nu a produs încă date consolidate. Trei dintre cei șase pacienți evidențiați în seria noastră de cazuri au făcut obiectul unui studiu imunohistochimic pentru evaluarea expresiei MYC, care a evidențiat o expresie ridicată la astfel de pacienți. Tabelul 1 raportează, de asemenea, caracteristicile histologice tumorale. Data diagnosticului RIAS a fost definită ca fiind ziua în care a fost pus diagnosticul histologic. Perioada de latență a fost definită ca fiind timpul scurs de la prima ședință de radioterapie și data diagnosticului RIAS. Doar un singur pacient a prezentat metastaze sincrone (în plămân) la diagnosticul de RIAS, în timp ce alți cinci pacienți au prezentat doar boală mamară.
Tabelul 1: Caracteristicile pacienților și procedurile de tratament. Vezi tabelul 1
Toți pacienții care au fost supuși unei intervenții chirurgicale la spitalul nostru au fost discutați în cadrul unei reuniuni multidisciplinare pentru sarcomi într-o fază preoperatorie. Pacienții au fost clasificați ca având boală rezecabilă dacă evaluarea preoperatorie indica faptul că o marjă negativă de 2 cm sau mai mare putea fi obținută prin intervenție chirurgicală cu sau fără reconstrucție chirurgicală plastică sub forma unui singur lambou miocutanat pediculat sau liber. În cazul în care marjele negative dorite necesitau o reconstrucție mai amplă, cum ar fi o resurfacere extinsă prin grefe cutanate mari, pacientul ar fi fost clasificat ca având o boală irezectabilă.
Boala rapid progresivă, în cazul în care volumul bolii a crescut într-un interval de timp de 2-3 săptămâni de la a fi potrivită pentru mastectomie singură sau în combinație cu un lambou pediculat la a necesita o reconstrucție mai extinsă, a fost, de asemenea, considerată irezectabilă din punct de vedere oncologic.
Biopsii preoperatorii au fost efectuate pentru a confirma prezența AS și a exclude alte boli.
Rezecțiunea completă prin metoda macroscopică a fost considerată de către chirurgul operator. Din punct de vedere histologic, rezecția a fost clasificată ca R0 (microscopic negativ) dacă marginile negative au fost mai mari de 1 cm pe circumferință sau R1 (microscopic pozitiv) dacă tumora s-a extins până la sau în mai puțin de 1 cm de la marginea de rezecție.
Patru pacienți au fost recrutați pentru re-iradiere imediată, în timp ce o pacientă a fost tratată după 13 luni, când a apărut o recidivă parietală (a refuzat re-iradierea imediată), ultimul pacient a fost exclus de la re-iradiere, deoarece atinsese limitele de doză pentru inimă în tratamentul anterior. Decizia privind administrarea de chimioterapie adjuvantă a fost luată de la caz la caz, pe baza datelor disponibile în legătură cu tratamentele anterioare primite și cu starea de performanță a pacienților. Un pacient a primit patru cicluri de chimioterapie cu epirubicină-ifosfamidă, unul epirubicină singură timp de șase cicluri, trei au fost excluși din motive medicale (vârstă, comorbidități sau doza de toleranță a antraciclinelor deja atinsă anterior). Un pacient a primit paclitaxel săptămânal timp de 12 cicluri pentru metastaze pulmonare sincrone.
Radioterapia a fost administrată ținând cont de dozele primite de țesuturile sănătoase la iradierea anterioară și de administrarea anterioară de antracicline. Din aceste motive, am ales să efectuăm re-iradierea prin radioterapie cu intensitate modulată (IMRT, a se vedea figura 1), utilizând o tehnică step-and-shoot, în conformitate cu procedurile noastre instituționale . Doza de radiație și schema de fracționare care au fost utilizate au variat: doi pacienți au primit fracționare convențională la 50 Gy, doi pacienți au primit 40 Gy (deoarece timpul scurs de la iradierea anterioară a fost scurt și neoplasmul a fost localizat pe sânul stâng), un pacient 35 Gy în fracții de 5 Gy o dată pe săptămână (din cauza complianței clinice reduse).
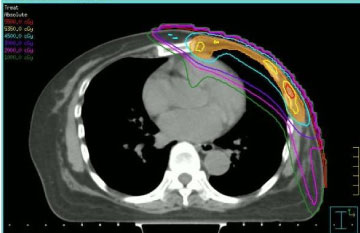 Figura 1: Imagine CT transversală cu distribuția de doză modulată în intensitate step-and-shot. Vezi figura 1
Figura 1: Imagine CT transversală cu distribuția de doză modulată în intensitate step-and-shot. Vezi figura 1
Rezultate
Nu au fost raportate margini pozitive la pacientele care au beneficiat de mastectomie radicală efectuată de aceeași echipă chirurgicală.
După mastectomia radicală, pacientele au primit tratament conform planului, fără întreruperi, atât pentru chimioterapie, cât și pentru radioterapie. La o perioadă mediană de urmărire de 22 de ani (interval: 1,5-4 ani), trei paciente sunt în viață, fără semne de recidivă sau boală progresivă. Un pacient cu metastaze pulmonare sincrone la momentul diagnosticului primește în continuare tratament oncologic activ. O pacientă a dezvoltat metastaze pulmonare și osoase, dar este încă în viață la momentul prezentării lucrării. Ultimii doi pacienți au dezvoltat metastaze pulmonare, dintre care una asociată cu recidivă locală, și au decedat după 8-10 luni (distribuția caracteristicilor pacienților în raport cu prezentarea bolii și tratamentul primit este descrisă în tabelul 1). În general, supraviețuirea fără boală a fost de 14 luni pentru cinci pacienți fără boală sistemică la diagnosticul de RIAS, în timp ce supraviețuirea fără progresie pentru pacientul cu metastaze sincrone la diagnostic a fost de 12 luni.
Așa cum ne putem aștepta, rezultatele mai slabe ale supraviețuirii, raportate în literatură, au fost remarcate la pacienții care s-au prezentat cu boală local avansată, nepotrivită pentru tratamentul chirurgical, în comparație cu cazurile din seria noastră. Acești factori evidențiază importanța diagnosticului precoce la pacientul cu RIAS. Angiosarcoamele se prezintă adesea insidios cu modificări cutanate de culoare purpurie sau roșie și pot fi ușor confundate cu echimoze sau modificări cutanate benigne, ceea ce duce la investigații și diagnosticare întârziate. Depistarea precoce și adresarea promptă pot reduce potențial numărul de pacienți care prezintă o boală irezectabilă și pot îmbunătăți controlul bolii atât la nivel local, cât și la distanță.
Discuție
Tumorile induse de radiații apar de obicei în contextul sau la marginea câmpului de iradiere, unde doza nu este uniformă și poate rezulta mai mică decât cea necesară pentru a induce distrugerea celulară, sau poate provoca mutații care pot duce la procesul de carcinogeneză. Ca efect al radiațiilor ionizante, modificările chimice și biochimice induse în organismele vii produc modificări funcționale și morfologice ale celulelor, cauzând un prejudiciu biologic. Fiecare celulă, capabilă să se reproducă, poate deveni potențial canceroasă; dacă celulele care prezintă modificări cromozomiale scapă controalelor celulare normale, poate avea loc carcinogeneza.
Probabilitatea de a dezvolta tumori la pacientele supuse radioterapiei pentru tratarea cancerului mamar este foarte scăzută și nu poate limita utilizarea radioterapiei atunci când este indicată. Dozele de radiații mai mari de 50 Gy induc moartea celulară, iar dozele mai mici (
Numeroase studii au sugerat corelația dintre apariția sarcoamelor țesuturilor moi și tratamentele cu radiații efectuate pentru tratarea tumorilor mamare. Radioterapia crește riscul de a dezvolta sarcoame ale țesuturilor moi și, în special, de a dezvolta angiosarcomul . RIAS reprezintă, aproximativ, mai puțin de 1% din tumorile mamare . Angiosarcomul radioindus are numeroase manifestări clinice: pacientele prezintă adesea modificări cutanate asimptomatice care pot fi cu greu diferențiate de alterările actinice comune care pot fi găsite după tratamentul de radioterapie la nivelul sânului. Pacientele prezintă adesea o umflătură palpabilă, o zonă roșie-violetă asemănătoare unui hematom. Angiosarcoamele pot fi confundate cu manifestări benigne, cum ar fi angioamele sau telangiectaziile atipice. Pot apărea, de asemenea, papule purpurii sau noduli eritematoși.
În ciuda tuturor eforturilor terapeutice, rata de supraviețuire la cinci ani variază de la 27% la 62,8% (2-3). Deși RIAS se dezvoltă de obicei la 10 ani după radioterapiile pentru cancerul de sân, perioada de latență poate varia de la 6 luni la 20 de ani. Angiosarcomul radioindus este imposibil de distins de angiosarcomul spontan, dar pot fi evaluate unele diferențe: Lae, et al. au comparat amplificarea c-myc pe cromozomul 8q24.21 în 32 de specimene RASB și 15 specimene de angiosarcom sporadic .
În seria noastră, pacienții au prezentat semne nespecifice de boală, dar diagnosticul a fost pus prompt în majoritatea cazurilor. Perioada de latență a fost în concordanță cu cea raportată în literatura de specialitate, cu un timp median de 76 de ani.
Se știe că RAS are o rată de recurență ridicată. Recurența locală, fie în patul tumoral, fie de-a lungul cicatricei chirurgicale, se pare că este detectată în majoritatea (96%) cazurilor de RIAS. Aceasta se datorează probabil creșterii multifocale a RIAS sau a resturilor de țesut malign după operație, chiar și cu margini chirurgicale negative. Boala metastatică, cel mai frecvent la plămâni și la ficat, poate fi prezentă în același timp sau la scurt timp după recidivele locale . Abbott, et al. au analizat retrospectiv toate cazurile de RIAS publicate până în 2017 și au rezumat datele . Autorii au constatat că rata de recurență locală a fost de 59% și că timpul median până la recurență a fost de 6 luni (interval, 1-78 luni). Ei au constatat, de asemenea, că boala metastatică a fost de obicei precedată de cel puțin o recidivă locală și că cele mai frecvente localizări au fost plămânii, sânul contralateral și scheletul. Mai mult, analiza lor histologică a 42 de cazuri a sugerat că RIAS slab diferențiat a fost asociat cu un risc ridicat de metastaze, în timp ce tumorile bine diferențiate au prezentat un risc mai mare de recidivă locală decât de metastaze la distanță.
Sarcomul indus de radiații este un neoplasm rar, dar foarte agresiv. Managementul său este un subiect de dezbatere, deoarece nu sunt disponibile ghiduri de tratament, prognosticul este slab și rata de supraviețuire la 5 ani variază foarte mult, așa cum s-a raportat anterior . Cu toate acestea, rezecția chirurgicală agresivă este în mod obișnuit susținută ca tratament de elecție.
Chirurgia, sub formă de mastectomie cu sau fără reconstrucție plastică, este tratamentul de elecție la pacienții care prezintă o boală localizată. În seriile de paciente aflate în tratament, este posibil să se obțină marje de rezecție microscopic complete (R0) la peste 80%. RIAS se prezintă de obicei ca leziuni multifocale. Tendința acestei patologii de a crea depozite de microsateliți poate contribui la dificultatea de a obține un control local.
Importanța efectuării unei rezecții patologice complete a fost subliniată în literatura de specialitate, deși nu au fost publicate orientări standard privind distanța de degajare recomandată. În seria actuală, s-a constatat că cei care au dezvoltat recidivă locală au avut margini mai apropiate decât cei care nu au avut recidivă. Cu toate acestea, în această serie nu s-a constatat că starea marginală este un prognostic independent al rezultatelor oncologice. Acest lucru ar sugera că abilitatea de a obține margini mai mari depinde de alți factori biologici tumorali care determină, de asemenea, rezultatul, cum ar fi dimensiunea. Este probabil ca biologia tumorii să fie în principal responsabilă pentru rezultatul în RIAS, deși chirurgia inițială ar trebui să vizeze eliminarea macroscopică, trebuie avertizat că obținerea unor margini negative mai mari nu echivalează neapărat cu rezultate mai bune pentru pacienți.
În ciuda numărului tot mai mare de studii care se concentrează pe chimioterapie și radioterapie, fie neoadjuvantă, fie adjuvantă, rolul acestora rămâne neclar. Există o lipsă de date care să dovedească eficacitatea chimioterapiei adjuvante, date recente au sugerat că radioterapia poate fi utilă în prevenirea recidivelor . Radioterapia adjuvantă după intervenția chirurgicală, conform lui Johnstone et al. permite un control local mai bun . Rolul IMRT în tratamentul peretelui toracic este în prezent în curs de evaluare, deoarece poate reduce rata de incidență a toxicității radioactivității prin diminuarea iradierii organelor de risc (OARs). Într-un studiu comparativ de dozimetrie, autorii raportează că planul IMRT la nivelul peretelui toracic și al țintei, în comparație cu tratamentele convenționale, permite scăderea dozei maxime, creșterea dozei minime, rezultând astfel o mai bună conformitate și uniformitate a volumului țintă .
Rolul și eficacitatea chimioterapiei nu au fost stabilite, deoarece datele disponibile provin din grupuri de eșantioane de dimensiuni mici, din care nu se pot trage concluzii definitive, dar probabil că pacienții cu grad de malignitate mai mare, G3 și cu recidivă, ar putea beneficia cel mai mult de chimioterapie neo sau adjuvantă .
S-a constatat, de asemenea, că utilizarea chimioterapiei neo/adjuvante a fost asociată cu un mai bun control local al bolii într-o serie retrospectivă mare de pacienți cu sarcoame radioinduse de toate localizările, deși nu a fost asociată cu rate îmbunătățite de recidivă sistemică sau de supraviețuire . Nu s-a constatat că chimioterapia adjuvantă produce un beneficiu în ceea ce privește controlul local sau un studiu de supraviețuire globală a sarcoamelor de țesut moale cu risc ridicat tratate prin chirurgie și radioterapie . Ca atare, există dovezi limitate care să sugereze că chimioterapia neo/adjuvantă produce un beneficiu în ceea ce privește supraviețuirea în cazul RIAS, deși, cu siguranță, poate fi utilă ca terapie de inducție înainte de intervenția chirurgicală în cazul celor care prezintă o boală local avansată și, în plus, poate oferi pacienților o paliație eficientă a bolii. Terapiile țintite pot oferi un tratament alternativ la pacienții cu boală progresivă.
În seria noastră, ca o consecință a tendinței ridicate spre recidivă locală a acestui neoplasm, am decis să propunem tuturor pacienților o a doua iradiere, cu excepția unuia dintre ei pentru problemele dosimetrice menționate mai sus. Un pacient a refuzat re-iradierea imediată și tratamentul a fost efectuat la recidivă. Nu a fost posibil să se programeze un tratament radiant omogen pentru toți pacienții, din cauza eterogenității eșantionului pentru dozele de iradiere utilizate anterior, a complianței clinice slabe într-un caz și, mai presus de toate, a lipsei unor indicații clare din literatura de specialitate și din ghiduri. În orice caz, am decis să administrăm tratamentul prin intermediul unei tehnici cu intensitate modulată, pentru a permite o distribuție adecvată a dozei, o reducere a expunerii la doză a țesuturilor sănătoase din jur, în special pentru parenchimul pulmonar subiacent și pentru inimă.
Concluzii
Radioterapia în tratamentul cancerului de sân este asociată cu un risc crescut de sarcom ulterior, dar procentul de risc este foarte scăzut.
RIAS este o leziune rară, agresivă a țesuturilor moi, cu opțiuni de tratament limitate și cu rate ridicate de recidivă atât locală, cât și sistemică.
Este necesară o observație atentă după radioterapia adjuvantă. Tratamentul standard implică o intervenție chirurgicală cu mastectomie simplă și radioterapie adjuvantă. Chimioterapia poate avea un rol în redimensionarea bolii local avansate, deși nu are un efect dovedit asupra supraviețuirii.
Angiosarcomul este semnificativ mai răspândit în cazurile tratate cu radioterapie, apărând în special în sau adiacent câmpului de radiație. Diferența mică în ceea ce privește riscul de sarcom ulterior pentru pacientele cu cancer de sân care primesc radioterapie nu înlocuiește beneficiul radioterapiei.
Cu toate acestea, seria noastră este prea mică pentru a trage concluzii finale și aceasta este o limitare a studiului. Este necesară o evaluare suplimentară, de asemenea printr-un număr mai mare de studii de caz, pentru a avea o mai bună clasificare a patologiei și pentru a permite un management multidisciplinar mai precis.
Conflicte de interese
Niciunul dintre autori nu are conflicte de interese de dezvăluit.
Surse de finanțare
Niciuna.
Aprobare etică
Aprobarea a fost acordată de către comitetul de etică al Universității din Catania.
Consimțământ informat
Consimțământul informat scris a fost obținut de la pacient pentru publicarea acestui raport de caz și a imaginilor care îl însoțesc. O copie a consimțământului scris este disponibilă pentru revizuire de către redactorul-șef al acestei reviste, la cerere.
Contribuții ale autorilor
Trovato Agata: Revizuirea și editarea articolului.
Înregistrarea studiilor de cercetare
Nimic.
Divulgarea
Niciunul dintre autori nu are nimic de dezvăluit.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Angiosarcom primar și secundar al sânului. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Rezultatele pe termen lung la pacienții cu angiosarcoame de sân asociate cu radiații după intervenții chirurgicale și radioterapie pentru cancerul de sân. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Radiation-induced sarcomas after radiotherapy for breast carcinoma: a large-scale single-institution review. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Angiosarcomul cutanat al sânului asociat cu radiații: prognostic slab în cazul unei malignități secundare rare. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Managementul clinic al angiosarcomului secundar după terapia de conservare a sânului. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Sarcomul de sân indus de radiații: o revizuire sistematică. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Risc crescut de sarcom de țesut moale după radioterapie la femeile cu carcinom mamar. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Angiosarcomul asociat cu radiații după cancerul de sân: rată ridicată de recurență și supraviețuire slabă în ciuda tratamentului chirurgical cu rezecție R0. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Gestionarea chirurgicală a angiosarcomului indus de radiații după terapia de conservare a sânului. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Angiosarcoame localizate: identificarea factorilor de prognostic și analiza impactului tratamentului. A retrospective analysis from the French Sarcoma Group (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Talidomida combinată cu chimioterapia neoadjuvantă în angiosarcomul de sân cu răspuns patologic complet: raport de caz și analiză a literaturii. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Chimioterapia neoadjuvantă pentru angiosarcomul primar cutanat/țesut moale: determinarea comportamentului tumoral înainte de rezecția chirurgicală. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Metastaze ganglionare limfatice contralaterale la o femeie cu un nou cancer de sân primar: Boală sistemică sau difuzie locoregională? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement: Orientări de consens privind raportarea cazurilor chirurgicale bazate pe consens. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Sarcoame secundare după radioterapia pentru cancerul de sân: risc susținut și supraviețuire slabă. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) Poate amplificarea c-myc să discrimineze în mod fiabil postradiație de angiosarcomul primar al sânului? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarcomul de sân în urma intervenției chirurgicale și a radioterapiei pentru cancerul de sân. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarcomul după terapia de conservare a sânului. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Sarcoame primare ale țesuturilor moi ale sânului: control local-regional cu radioterapie postoperatorie. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Evaluarea dozimetrică a tratamentului IMRT integrat al peretelui toracic și al regiunii supraclaviculare pentru cancerul de sân după mastectomia radicală modificată. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) O meta-analiză sistematică a studiilor controlate randomizate de chimioterapie adjuvantă pentru sarcomul localizat rezecabil al țesuturilor moi. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Chimioterapie adjuvantă cu doxorubicină, ifosfamidă și lenograstim pentru sarcomul rezecat al țesuturilor moi (EORTC 62931): un studiu controlat randomizat multicentric. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Cazuri de tuberculoză mamară în creștere în Sicilia. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Rolul, calendarul și tehnica radioterapiei în sarcomul sinovial pleuropulmonar pediatric. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Radioterapie cu intensitate modulată pentru mezoteliomul pleural malign recidivat. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Experiența unei singure instituții de radioterapie cu intensitate modulată pentru mezoteliomul pleural malign la Universitatea din Catania. Future Oncol 14: 17-21.
Citație
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Multidisciplinary Management. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114
.