La struttura di Lewis dello ione ossalato è disegnata in questo tutorial passo dopo passo. Il concetto di elettroni di valenza totale è usato per disegnare la struttura di Lewis di C2O42-. Dopo aver finito la struttura di Lewis di C2O42-, ci dovrebbe essere una carica -2 e una stabilità. Imparerai queste cose in questo tutorial.
Ione ossalato | C2O42-
Lo ione carbonato ha una carica -2. Ci sono due atomi di carbonio nello ione ossalato.
C2O42- struttura di Lewis
Due atomi di carbonio sono uniti ad un atomo di carbonio. Così come gli altri due atomi di ossigeno sono uniti ad altri atomi di carbonio. Nella struttura di lewis dello ione C2O42-, lo ione è simmetrico intorno al legame C-C.
Passi per disegnare la struttura di lewis di C2O42-
I seguenti passi sono necessari per disegnare la struttura di lewis di C2O42- e sono spiegati in dettaglio in questo tutorial.
- Trova il numero totale di elettroni dei gusci di valenza degli atomi di carbonio e ossigeno. Questo è usato per determinare il numero di legami, coppie solitarie intorno agli atomi.
- Totale coppie di elettroni intorno agli atomi
- Selezione dell’atomo centrale secondo la valenza massima
- Mettere coppie solitarie sugli atomi
- Verificare la stabilità e minimizzare le cariche sugli atomi per costruire la struttura più stabile convertendo le coppie solitarie in legami.
Come questi passi, i seguenti fatti sono importanti per disegnare la struttura lewis.
L’ossigeno dovrebbe avere cariche negative nella struttura di Lewis perché all’ossigeno piace mantenere gli elettroni rispetto all’atomo di carbonio.
L’elettronegatività dell’ossigeno è più alta di quella del carbonio.
Disegnare la struttura di lewis corretta è importante per disegnare correttamente le strutture di risonanza di CO32-.
Numero totale di elettroni dei gusci di valenza di C2O42-
Il carbonio si trova nel gruppo 4 della tavola periodica. Quindi, il carbonio ha quattro elettroni nel suo guscio di valenza. L’ossigeno si trova nel 6° gruppo. Ha sei elettroni nel guscio di valenza.
- Totale elettroni di valenza dati dall’atomo di carbonio = 4 * 2 = 8
Ci sono quattro atomi di ossigeno nello ione C2O42-, quindi
- Totale elettroni di valenza dati dagli atomi di ossigeno = 6 *4 = 24
Ci sono -2 cariche su C2O42-. Quindi ci sono due elettroni in più che contribuiscono agli elettroni di valenza.
- Totale elettroni di valenza = 8 + 24 + 2 = 34
Totale coppie di elettroni di valenza
Totale coppie di elettroni di valenza = σ legami + π legami + coppie solitarie nei gusci di valenza
Le coppie totali di elettroni sono determinate dividendo il numero totale di elettroni di valenza per due. Per lo ione C2O42-, le coppie totali di elettroni sono 17.
Atomo centrale dello ione C2O42-
Per essere l’atomo centrale, è importante la capacità di avere valenza più alta. Il carbonio ha più possibilità di essere l’atomo centrale (vedi la figura) perché il carbonio può mostrare una valenza di 4. La valenza più alta dell’ossigeno è 2. Quindi, ora possiamo costruire uno schizzo dello ione C2O42-.
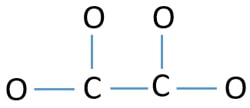
Coppie solitarie sugli atomi
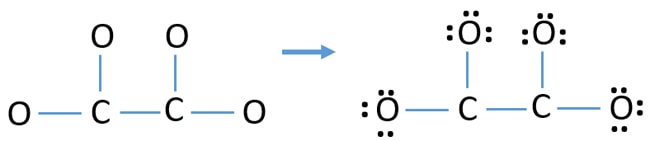
- Ci sono quattro legami C-O e un legame C-C nello schizzo di sopra, facendo cinque legami. Quindi rimangono solo dodici (17-5 = 12) coppie di elettroni di valenza.
- Prima di tutto, segna quelle dodici coppie di elettroni di valenza come coppie solitarie negli atomi esterni (sugli atomi di ossigeno). Un atomo di ossigeno prenderà tre coppie solitarie seguendo la regola ottale (l’atomo di ossigeno non può mantenere più di otto elettroni nel suo guscio di valenza).
- Per quattro atomi di ossigeno, dodici coppie di elettroni sono spese. Ora, non ci sono più coppie solitarie da marcare sugli atomi di carbonio dopo aver marcato le coppie solitarie sugli atomi di ossigeno (fuori dagli atomi).
Cariche sugli atomi
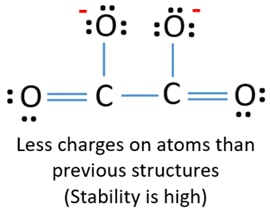
Dopo aver marcato le coppie di elettroni sugli atomi (in questo caso, solo sugli atomi di ossigeno), dovremmo marcare le cariche di ogni atomo se esiste una carica. La marcatura delle cariche è significativa perché serve a determinare la migliore struttura di lewis dello ione. Dopo aver segnato le cariche, vedrai che ogni atomo di ossigeno avrà una carica -1 ed entrambi gli atomi di carbonio avranno una carica +1.
Questa struttura è molto instabile perché ci sono cariche ovunque nello ione.
Controlla la stabilità e minimizza le cariche sugli atomi convertendo le coppie solitarie in legami
- Gli atomi di ossigeno dovrebbero avere cariche negative perché l’elettronegatività dell’atomo di ossigeno è maggiore di quella dell’atomo di carbonio. Altrimenti, possiamo dire che la capacità di trattenere le cariche negative è maggiore negli atomi di ossigeno che in quelli di carbonio.
- La struttura disegnata non è stabile perché tutti gli atomi hanno una carica (la struttura di Lewis dovrebbe essere stabile con meno cariche).
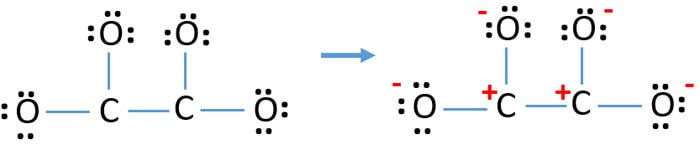
- Ora, dovremmo cercare di minimizzare le cariche convertendo le coppie solitarie in legami. Quindi convertire una coppia solitaria di un atomo di ossigeno per fare un legame C-O.
- Ora c’è un doppio legame tra un atomo di carbonio e uno di ossigeno (un legame C=O). Ora, ci sono tre legami singoli tra l’atomo di carbonio e altri tre atomi di ossigeno (due legami C-O).
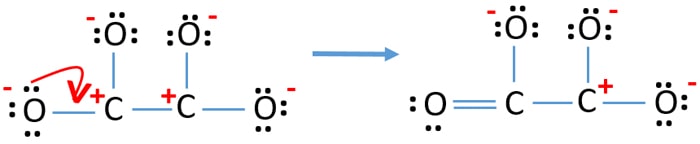
Nella nuova struttura, le cariche degli atomi sono ridotte rispetto alla struttura precedente. Ora non ci sono cariche su un atomo di ossigeno e un atomo di carbonio. Ma ci sono ancora cariche su tre atomi di ossigeno (hanno -1 carica negativa) e sull’altro atomo di carbonio. Ora capisci che questa struttura di C2O42- è più stabile della struttura precedente. Ma, cerchiamo di ridurre le cariche il più possibile.
Ridurre le cariche inoltre
Puoi convertire la coppia solitaria di un altro atomo di ossigeno in un legame C-O come sotto.
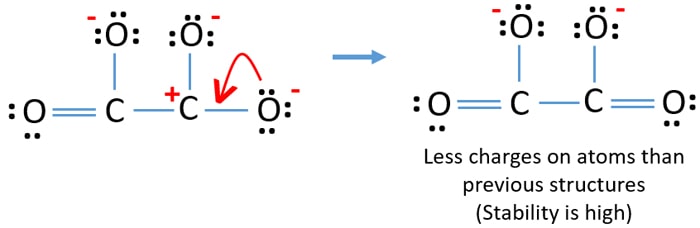
Struttura lewis dello ione C2O42- (carbonato)
Domande
Fai le tue domande di chimica e trova le risposte
Tutorial correlati