 All materia, vare sig den är levande eller inte, består av kemiska grundämnen; dessa är grundläggande kemikalier i den meningen att de är vad de är – de kan inte omvandlas till ett annat grundämne. Varje grundämne kännetecknas av det antal protoner
All materia, vare sig den är levande eller inte, består av kemiska grundämnen; dessa är grundläggande kemikalier i den meningen att de är vad de är – de kan inte omvandlas till ett annat grundämne. Varje grundämne kännetecknas av det antal protoner , neutroner
, neutroner och elektroner
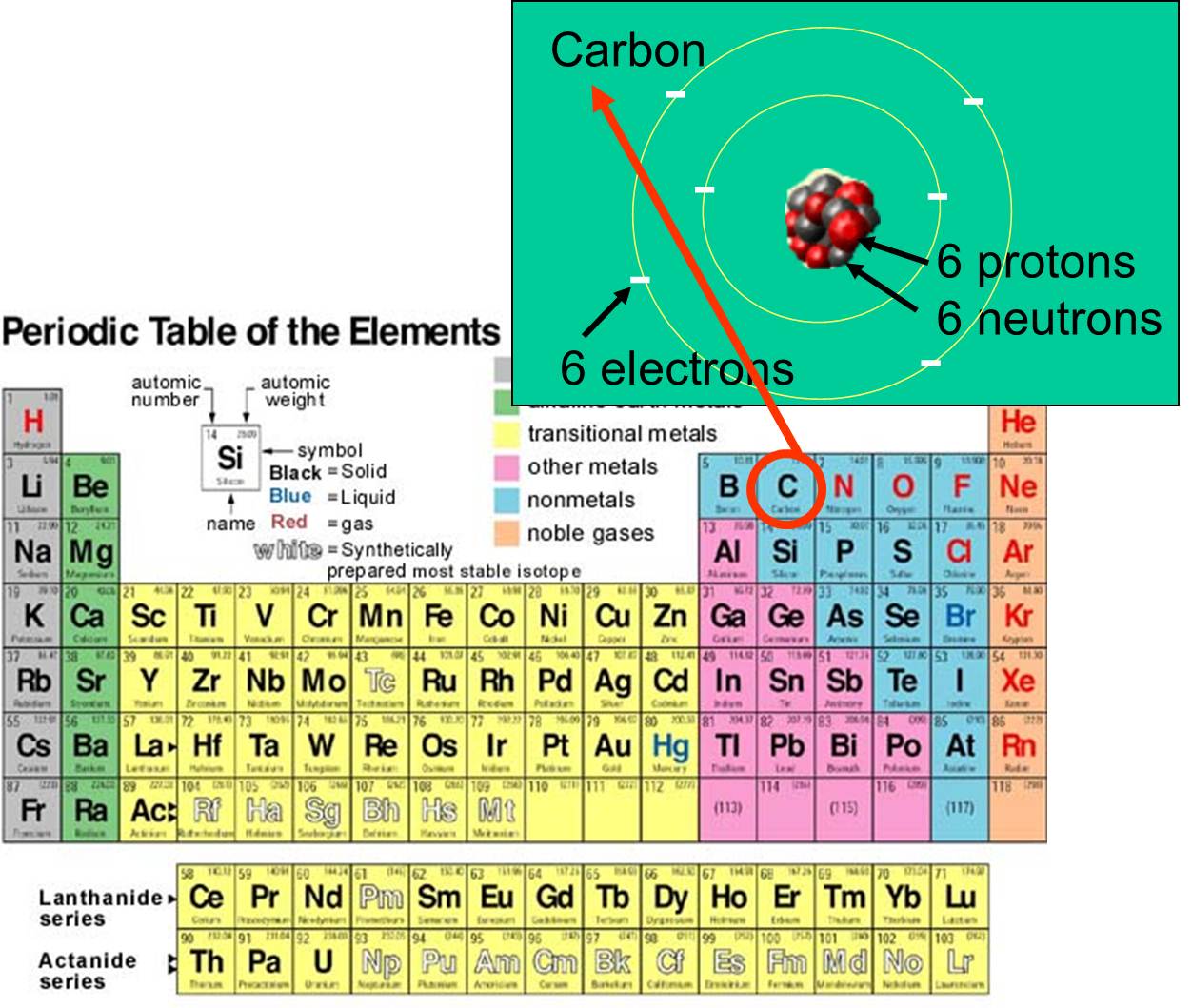
och elektroner som det besitter. Kolets atomnummer är till exempel 6 och har en atommassa på cirka 12, eftersom det har 6 positivt laddade protoner och 6 oladdade neutroner. De 6 laddade elektronerna bidrar mycket lite till atommassan. Det finns 92 naturligt förekommande grundämnen på jorden. Ordningen av grundämnen och deras subatomära struktur sammanfattas i det periodiska systemet över grundämnena, som visas till höger.
som det besitter. Kolets atomnummer är till exempel 6 och har en atommassa på cirka 12, eftersom det har 6 positivt laddade protoner och 6 oladdade neutroner. De 6 laddade elektronerna bidrar mycket lite till atommassan. Det finns 92 naturligt förekommande grundämnen på jorden. Ordningen av grundämnen och deras subatomära struktur sammanfattas i det periodiska systemet över grundämnena, som visas till höger.
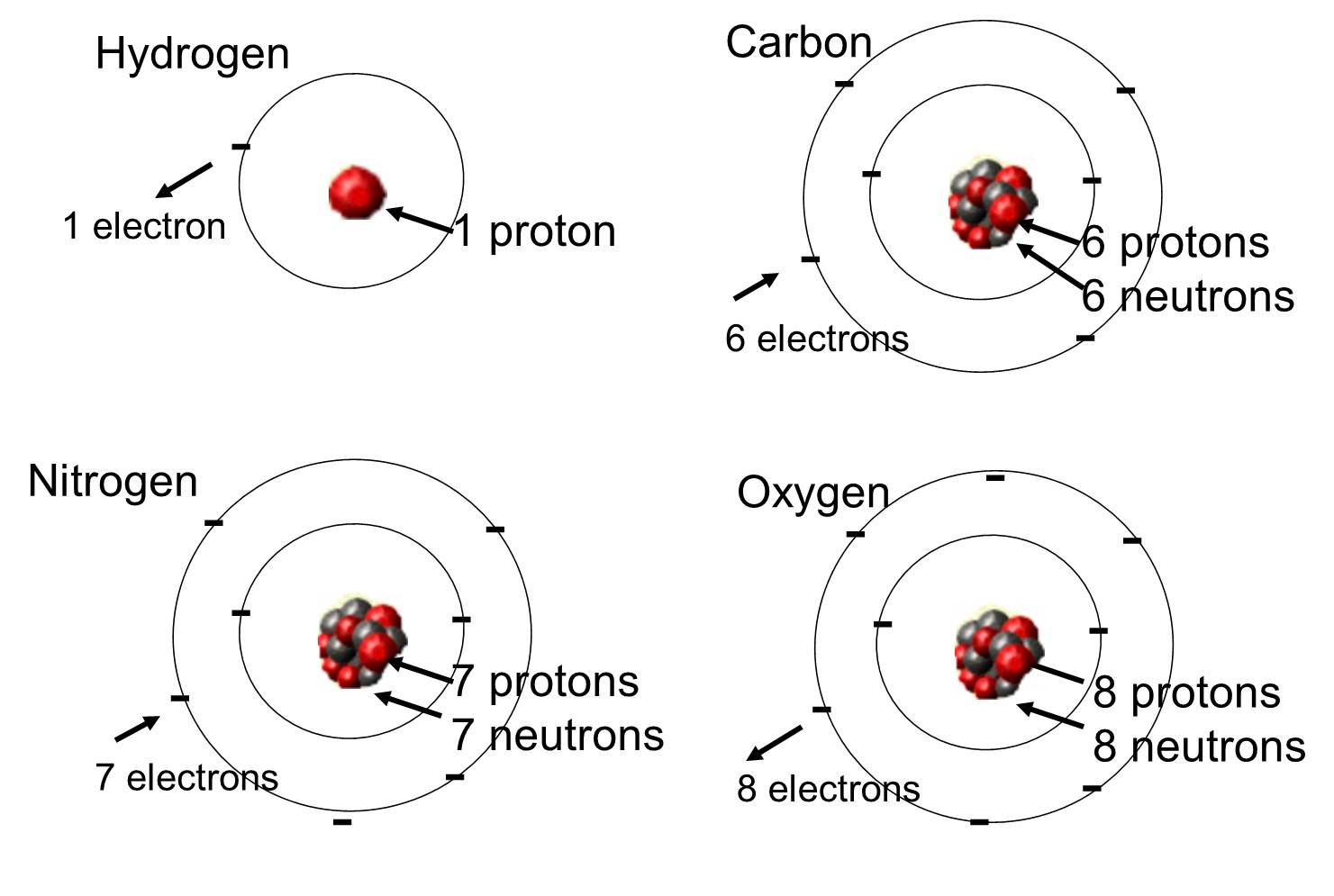
I levande organismer är de vanligaste grundämnena kol, väte och syre. Dessa tre grundämnen tillsammans med kväve, fosfor och en handfull andra grundämnen utgör den stora majoriteten av levande materia. En atom är en enda enhet av ett kemiskt grundämne. Några av dessa grundämnen som förekommer rikligt i organiska molekyler visas nedan.
 Atomer kan kombinera sig med andra atomer genom att bilda kemiska bindningar.
Atomer kan kombinera sig med andra atomer genom att bilda kemiska bindningar.
Kovalenta bindningar
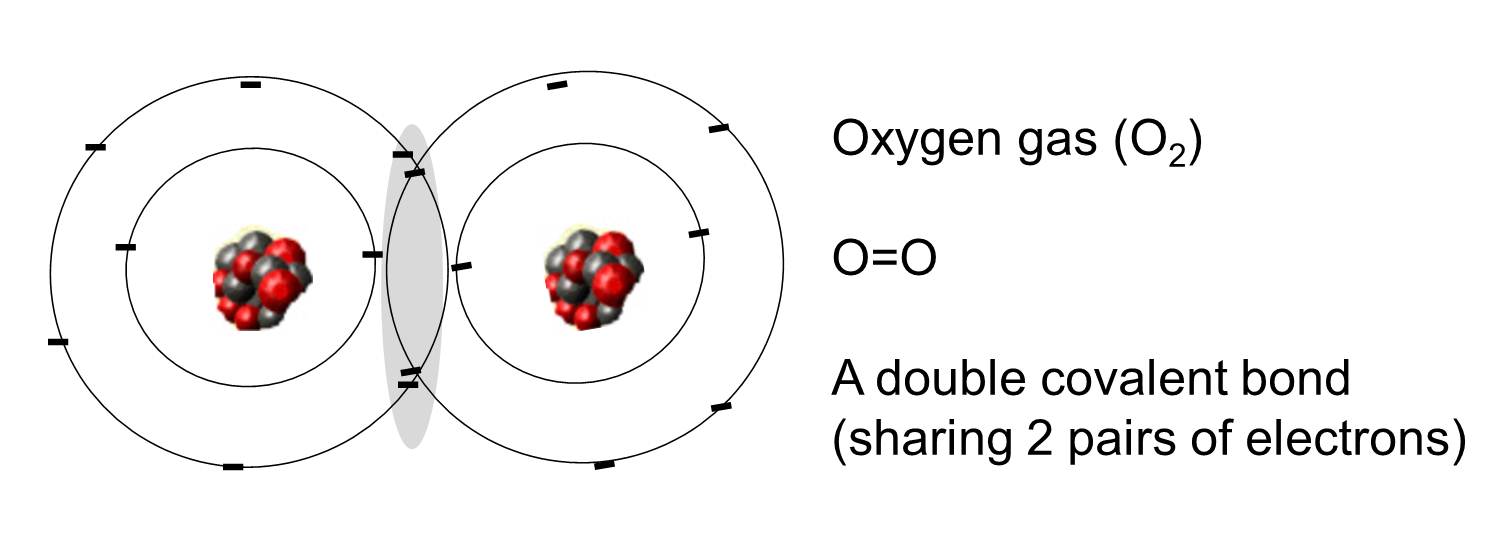
En kovalent bindning är en bindning där ett eller flera elektronpar delas av två atomer. Illustrationen till höger visar två syreatomer som är kovalent bundna genom att två elektronpar delas, vilket illustreras i det skuggade området.
Figuren nedan visar en serie molekyler som bildas genom kovalent bindning. Håll musen över varje molekyl för att se en kort beskrivning.
, 
Vatten är en polär molekyl
Bemärk också att delningen av elektroner inte alltid är lika stor. I en vattenmolekyl tillbringar till exempel de negativt laddade elektronerna mer tid i närheten av den tyngre syreatomen.
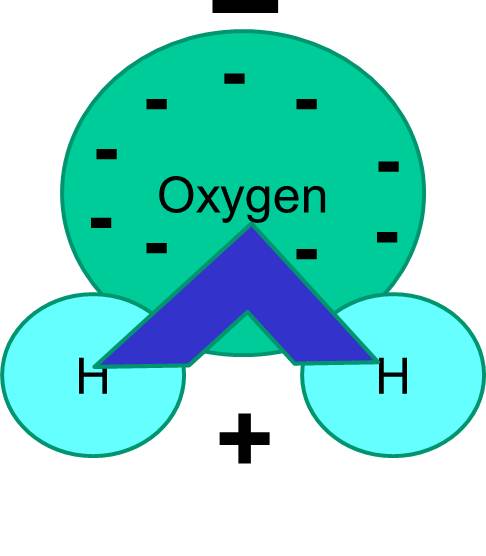
Nettoresultatet är att vattenmolekylen har en ände som är mer negativ i förhållande till den andra änden. Vatten är därför en ”polär” molekyl. Vi kommer att se att denna polaritet har viktiga konsekvenser för många biologiska fenomen, inklusive cellstrukturen. Du kanske har hört uttrycket ”lika löser lika”. Det betyder att polära molekyler löser sig bra i polära vätskor som vatten. Socker (t.ex. glukos) och salter är polära molekyler och de löser sig i vatten, eftersom de positiva och negativa delarna av de två typerna av molekyler kan fördela sig bekvämt mellan varandra.
Ioniska bindningar
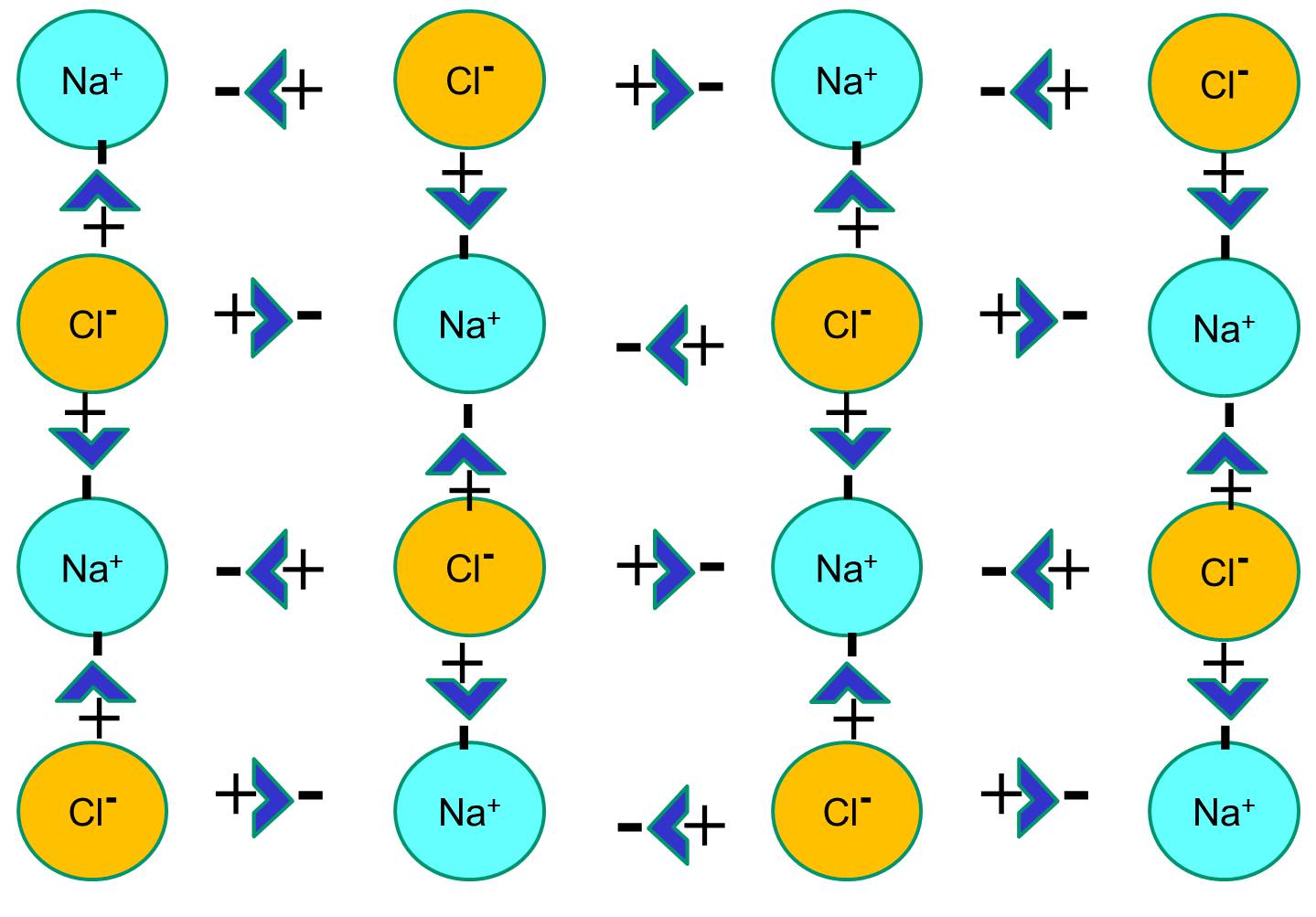
Natrium har en enda elektron i sitt yttersta orbitalskal, och det är termodynamiskt stabilare om det avger denna elektron. Denna förlust av en negativ elektron resulterar i en positivt laddad natriumjon, som förkortas Na+. Klor har å andra sidan sju elektroner i sitt yttersta orbitalskal, och det är termodynamiskt stabilare om det får en extra elektron för att komplettera det yttersta orbitalskalet. Detta resulterar i en negativt laddad kloridjon, som förkortas Na+. De positivt laddade natriumjonerna och de negativt laddade kloridjonerna attraherar varandra och resulterar i bildandet av en jonisk bindning. I avsaknad av vatten bildar natrium och klorid ett kristallgitter på grund av attraktionen av negativa och positiva joner.
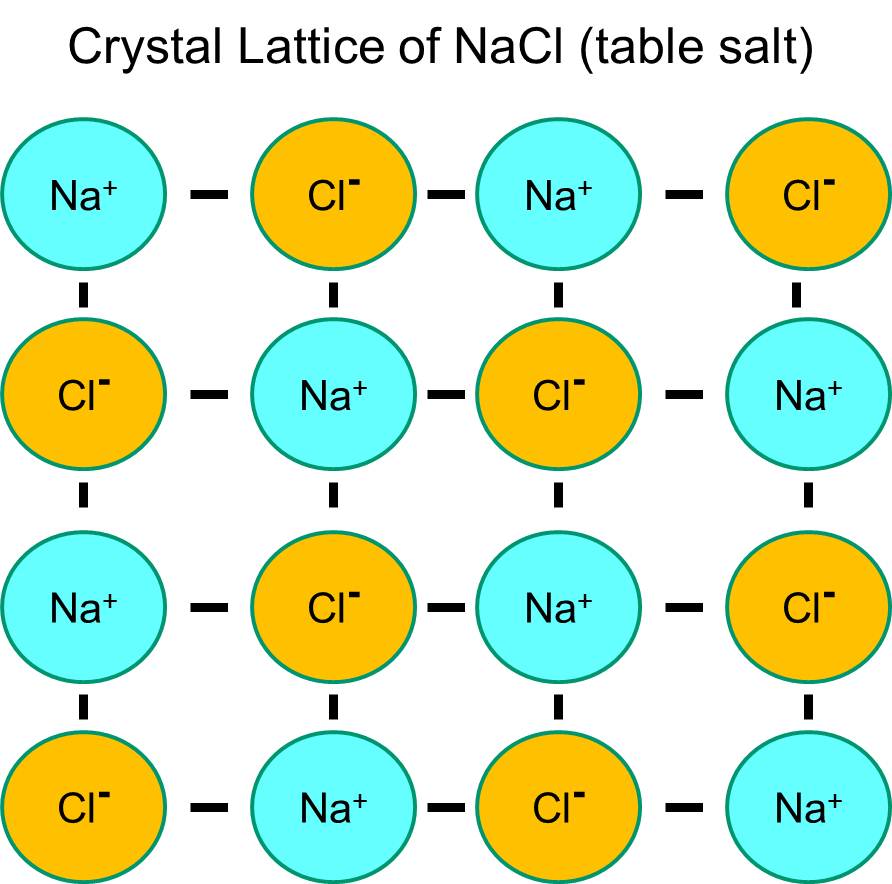
Om natriumkloridkristaller placeras i vatten kommer dock de polära vattenmolekylerna att ”hydrera” natrium- och kloridatomerna eftersom vattenmolekylerna är polära. I illustrationen nedan representerar de mörkare blå V-formade figurerna vattenmolekyler, som är polära. Vattenmolekylernas positiva ändar dras till de negativt laddade kloridjonerna, medan vattenmolekylernas negativa pol dras till de positiva natriumjonerna. Som ett resultat av detta hydreras jonerna och kristallgitteret löses upp i den vattenhaltiga lösningen. Detta är exakt vad som händer när man tillsätter kristallint bordssalt i ett glas vatten.