Abstract
Lo scopo di questo studio, incentrato su un piccolo numero di casi, è quello di affrontare l’angiosarcoma del seno, che rappresenta meno dell’1% di tutti i tumori dei tessuti molli del seno, e infine condividere la nostra esperienza. Come conseguenza della terapia di conservazione del seno (BCT) che è il trattamento standard al giorno d’oggi, è stato evidenziato un nuovo tipo di angiosarcoma: L’angiosarcoma indotto da radiazioni (RIAS).
Qui viene riportata un’analisi retrospettiva delle caratteristiche dei pazienti RIAS, insieme a un resoconto del trattamento integrato e l’esito di sei casi di RIAS trattati nel nostro istituto dal 2013 al 2018.
L’angiosarcoma del seno come conseguenza della chirurgia e della radioterapia è stato registrato raramente, ma è una complicazione documentata del trattamento radiante per il cancro al seno, con un alto tasso di recidiva e scarsi risultati.
Si tratta di una sfida dal punto di vista clinico, radiologico e istologico, e quindi è necessario un alto indice di sospetto nelle pazienti suscettibili. La mastectomia semplice è l’opzione di trattamento primaria, tuttavia, un numero crescente di studi sull’uso della radioterapia e della chemioterapia, ciascuno con un grado variabile di successo, si sta concentrando. La re-irradiazione può essere presa in considerazione per aumentare il controllo locale, mentre la chemioterapia può essere considerata per i casi in uno stadio più avanzato.
Abbreviazione
RIAS: Radiation-Induced Angiosarcoma; BCT: Breast-Conserving Therapy; AS: Breast Angiosarcoma; MRI: Risonanza Magnetica; IMRT: Intensity-Modulated Radiotherapy
Keywords
Angiosarcoma del seno (AS), Angiosarcoma indotto da radiazioni (RIAS), Mastectomia radicale (RM), Tumori indotti da radiazioni, Radioterapia adiuvante, Intensity-Modulated Radiotherapy (IMRT)
Introduzione
In questo lavoro vengono discussi diagnosi, gestione ed esito del RIAS in un piccolo numero di pazienti con cancro al seno.
Come tumore vascolare molto raro, l’angiosarcoma della mammella (AS) può essere diviso in primario, se nasce senza un precursore noto, o secondario, se si verifica nel sito della pelle precedentemente irradiata, nel qual caso è noto come angiosarcoma indotto dalle radiazioni (RIAS) della mammella. Ma, ancora, non esistono linee guida basate sull’evidenza riguardanti il trattamento ideale degli angiosarcomi.
Nei pazienti sottoposti a chirurgia conservativa del seno con radioterapia adiuvante, l’incidenza stimata di RIAS varia tra lo 0,05 e lo 0,3%, rappresentando meno dell’1% dei tumori del seno e circa il 3% di tutti i sarcomi dei tessuti molli.
L’incidenza di RIAS sembra essere in aumento, forse riflettendo il lungo periodo di latenza per lo sviluppo di questi tumori dopo l’adozione diffusa della radioterapia adiuvante per il cancro al seno.
La diagnosi di RIAS del seno è spesso ritardata a causa del suo aspetto benigno e la difficoltà di differenziarla dai cambiamenti cutanei aspecifici indotti da radiazioni precedenti o da un’altra malattia. Anche i risultati radiologici sono spesso aspecifici. Anche se la RIAS si sviluppa tipicamente 10 anni dopo il trattamento radioterapico per il cancro al seno, il periodo di latenza può variare da 6 mesi a 20 anni, portando alcuni autori a credere che sia probabilmente sottostimata e che i veri tassi di incidenza siano quindi più alti. Poiché l’incidenza del cancro al seno è in aumento, l’uso della chirurgia di conservazione del seno seguita da radioterapia ha sostituito la mastectomia radicale come trattamento standard. Anche l’incidenza associata di RIAS è in aumento, con un’incidenza cumulativa stimata di 0,9-3,2 per 1000 casi di cancro al seno. In un ampio studio di coorte basato sulla popolazione, una storia di radioterapia precedente come trattamento per il cancro al seno è stata associata ad un aumento di 26 volte del rischio di sviluppare un angiosarcoma rispetto ai gruppi di controllo non irradiati. La prognosi per i pazienti con RIAS rimane povera, con tassi di sopravvivenza globale a 5 anni che vanno dal 27 al 48%. Nonostante il fatto che la RIAS sia stata descritta per la prima volta nei primi anni ’20, la sua biologia molecolare è ancora controversa e non c’è quindi una terapia mirata disponibile.
Attualmente, la resezione chirurgica aggressiva è comunemente raccomandata come trattamento di scelta. Mancano dati che dimostrino l’efficacia della chemioterapia adiuvante.
La chirurgia, sotto forma di ampia escissione o mastectomia, è il pilastro della gestione della malattia localizzata. Alcuni studi hanno riportato un’associazione tra i margini R0 e il miglioramento del tasso di sopravvivenza, anche se non è stato dimostrato che sia indipendente da altri fattori biologici, come le dimensioni del tumore. Ci sono alcune prove che la chemioterapia neoadiuvante può migliorare gli esiti nel trattamento dell’angiosarcoma, la cui rarità limita la nostra conoscenza a case report o piccole serie di casi retrospettivi.
Al fine di caratterizzare una popolazione di pazienti con RIAS, trattati presso il nostro ospedale per un periodo di 5 anni, abbiamo eseguito uno studio retrospettivo analizzando l’utilità della mammografia, ecografia e risonanza magnetica (MRI) per la nostra diagnosi
Il nostro lavoro è stato riportato in linea con i criteri SCARE.
Materiali e Metodi
La nostra casistica riguarda pazienti con angiosarcoma mammario istologicamente provato, sviluppatosi dopo radioterapia per carcinoma mammario, tra il 2013 e il 2018, e analizza le strategie di trattamento con un approccio multidisciplinare.
I pazienti affetti, sei femmine con angiosarcoma mammario radioindotto, sono stati identificati attraverso una ricerca globale nel suddetto periodo del registro tumori della nostra istituzione, presso l’Azienda Ospedaliera Universitaria di Catania. L’età media era di 70 anni, range: 59-79 anni. I pazienti avevano effettuato la precedente gestione diagnostica e terapeutica presso varie istituzioni, per cui le informazioni non sono tutte disponibili. La descrizione delle caratteristiche dei pazienti e delle procedure di trattamento eseguite dopo la diagnosi di RIAS sono descritte nella tabella 1. Tutte le pazienti erano state sottoposte a trattamento di conservazione del seno al momento della diagnosi, con radioterapia adiuvante somministrata mediante radioterapia convenzionale 3-dimensionale conforme a una dose totale di 50 Gy, con frazionamento giornaliero di 2 Gy, con o senza un boost del letto tumorale di 10 Gy. I tumori erano di lato destro in 3 pazienti e di lato sinistro negli altri 3. Durante il trattamento adiuvante, cinque pazienti su sei hanno ricevuto una chemioterapia sistemica a base di antracicline, secondo le linee guida istituzionali, mentre tutte le pazienti hanno ricevuto una terapia ormonale adiuvante a base di tamoxifene/inibitore dell’aromatasi. Nessuna paziente aveva un cancro HER2-positivo al momento della diagnosi.
Durante il follow-up, dopo un periodo mediano di 7,6 anni (range: 5-11 anni), è stata effettuata la diagnosi di angiosarcoma mammario omolaterale: i segni più frequentemente esibiti dalle pazienti all’esordio erano noduli cutanei di colore rosso-viola, localizzati nel contesto dei campi di irradiazione, con un tasso di crescita moderatamente variabile da poche settimane a 4-6 mesi. Tutte le pazienti hanno ricevuto una conferma istologica di angiosarcoma secondario e in tutti i casi è stata eseguita una mastectomia radicale. Per diagnosticare la RIAS, sono stati seguiti i criteri di Cahan e Arlen: un sarcoma che sorge all’interno del precedente campo irradiato; un periodo di latenza di almeno 3 anni tra la radioterapia e lo sviluppo del sarcoma; e una distinzione istologica tra il sarcoma secondario e la neoplasia primaria. Tutte e sei le pazienti hanno ricevuto un work-up radiologico completo con mammografia, ecografia e risonanza magnetica (in 4/6 pazienti) nel tentativo di confermare il sospetto clinico di RIAS, ma non sono state identificate caratteristiche patognomoniche. Il crescente interesse della letteratura scientifica nell’identificare caratteristiche specifiche della “firma da radiazione” non ha ancora prodotto dati consolidati. Tre dei sei pazienti evidenziati nella nostra casistica sono stati oggetto di uno studio immunoistochimico per la valutazione dell’espressione di MYC, che aveva mostrato un’elevata espressione su tali pazienti. La tabella 1 riporta anche le caratteristiche istologiche del tumore. La data della diagnosi di RIAS è stata definita come il giorno in cui è stata fatta la diagnosi istologica. Il periodo di latenza è stato definito come il tempo trascorso tra la prima sessione di radiazioni e la data della diagnosi di RIAS. Solo un paziente ha mostrato metastasi sincrone (nel polmone) alla diagnosi di RIAS, mentre altri cinque pazienti hanno mostrato solo la malattia del seno.
Tabella 1: Caratteristiche dei pazienti e procedure di trattamento. Visualizza Tabella 1
Tutti i pazienti sottoposti a intervento chirurgico presso il nostro ospedale sono stati discussi in una riunione multidisciplinare sul sarcoma in fase pre-operatoria. I pazienti sono stati classificati come aventi una malattia resecabile se la valutazione pre-operatoria indicava che un margine negativo di 2 cm o superiore poteva essere ottenuto con un intervento chirurgico con o senza ricostruzione plastica sotto forma di un singolo lembo miocutaneo peduncolato o libero. Se i margini negativi desiderati richiedevano una ricostruzione più estesa, come ad esempio un ampio resurfacing con un grande innesto di pelle, il paziente sarebbe stato classificato come affetto da malattia irresecabile.
La malattia rapidamente progressiva, in cui il volume della malattia aumentava in un lasso di tempo di 2-3 settimane dall’essere adatta alla mastectomia da sola o in combinazione con un lembo peduncolato a richiedere una ricostruzione più estesa, veniva anche giudicata irresecabile in termini oncologici.
Venivano eseguite biopsie preoperatorie per confermare la presenza di AS ed escludere altre malattie.
La resezione completa macroscopicamente veniva considerata dal chirurgo operante. Istologicamente, la resezione è stata classificata come R0 (microscopicamente negativa) se i margini negativi erano più di 1 cm di circonferenza o R1 (microscopicamente positiva) se il tumore si estendeva a o entro meno di 1 cm dal margine di resezione.
Quattro pazienti sono stati reclutati per la re-irradiazione immediata, mentre un paziente è stato trattato dopo 13 mesi quando si è verificata una recidiva parietale (aveva rifiutato la re-irradiazione immediata), l’ultimo paziente è stato escluso dalla re-irradiazione, poiché aveva raggiunto i limiti di dose per il cuore nel trattamento precedente. La decisione sulla somministrazione della chemioterapia adiuvante è stata presa caso per caso, sulla base dei dati disponibili in relazione ai precedenti trattamenti ricevuti e al performance status dei pazienti. Una paziente ha ricevuto quattro cicli di chemioterapia epirubicina-ifosfamide, una epirubicina da sola per sei cicli, tre sono state escluse per motivi medici (età, comorbidità o dose di tolleranza delle antracicline già raggiunta in precedenza). Un paziente ha ricevuto paclitaxel settimanale per 12 cicli per metastasi polmonari sincrone.
La radioterapia è stata somministrata tenendo conto delle dosi ricevute dai tessuti sani nella precedente irradiazione e nella precedente somministrazione di antracicline. Per questi motivi, abbiamo scelto di effettuare la re-irradiazione per mezzo di radioterapia ad intensità modulata (IMRT, vedi Figura 1), utilizzando una tecnica step-and-shoot, secondo le nostre procedure istituzionali. La dose di radiazione e lo schema di frazionamento utilizzati sono stati diversi: due pazienti hanno ricevuto un frazionamento convenzionale a 50 Gy, due pazienti hanno ricevuto 40 Gy (perché il tempo trascorso dalla precedente irradiazione era breve e la neoplasia era localizzata sul seno sinistro), una paziente 35 Gy in frazioni da 5 Gy una volta alla settimana (a causa della ridotta compliance clinica).
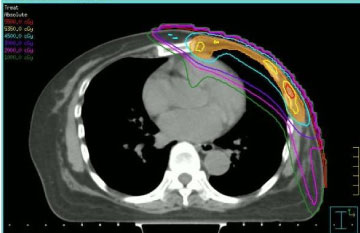 Figura 1: Immagine CT trasversale con distribuzione della dose modulata per intensità step-and-shot. Vedi Figura 1
Figura 1: Immagine CT trasversale con distribuzione della dose modulata per intensità step-and-shot. Vedi Figura 1
Risultati
Nessun margine positivo è stato riportato nelle pazienti che avevano ricevuto una mastectomia radicale eseguita dallo stesso team chirurgico.
Dopo la mastectomia radicale, le pazienti hanno ricevuto il trattamento come previsto, senza alcuna interruzione, sia per la chemioterapia che per la radioterapia. Ad un tempo mediano di follow-up di 22 anni (range: 1,5-4 anni), tre pazienti sono vive, senza evidenza di recidiva o malattia progressiva. Un paziente con metastasi polmonari sincrone alla diagnosi sta ancora ricevendo un trattamento oncologico attivo. Una paziente ha sviluppato metastasi polmonari e ossee, ma è ancora viva al momento della presentazione del lavoro. Gli ultimi due pazienti hanno sviluppato metastasi polmonari, una delle quali associata a recidiva locale, e sono morti dopo 8-10 mesi (la distribuzione delle caratteristiche dei pazienti in relazione alla presentazione della malattia e al trattamento ricevuto è descritta nella tabella 1). Nel complesso, la sopravvivenza libera da malattia era di 14 mesi per cinque pazienti senza malattia sistemica alla diagnosi di RIAS, mentre la sopravvivenza libera da progressione per il paziente metastatico sincrono alla diagnosi era di 12 mesi.
Come ci si può aspettare, i risultati di sopravvivenza più poveri, riportati in letteratura, sono stati notati in pazienti che presentavano una malattia localmente avanzata non adatta alla gestione chirurgica rispetto ai casi della nostra serie. Questi fattori evidenziano l’importanza della diagnosi precoce nel paziente RIAS. Gli angiosarcomi si presentano spesso in modo insidioso con cambiamenti cutanei viola o rossi e possono essere facilmente scambiati per ecchimosi o cambiamenti cutanei benigni che portano a indagini e diagnosi ritardate. La diagnosi precoce e l’invio tempestivo possono potenzialmente ridurre il numero di pazienti che mostrano una malattia irresecabile e migliorare il controllo della malattia sia locale che a distanza.
Discussione
I tumori indotti dalle radiazioni sorgono tipicamente nel contesto o al bordo del campo di irradiazione dove la dose non è uniforme e può risultare inferiore a quella necessaria per indurre la distruzione cellulare, o causare mutazioni che possono portare al processo di carcinogenesi. Come effetto delle radiazioni ionizzanti, le modifiche chimiche e biochimiche indotte negli organismi viventi producono alterazioni funzionali e morfologiche delle cellule causando un danno biologico. Ogni cellula, in grado di replicarsi, può diventare potenzialmente cancerosa; se le cellule che presentano modifiche cromosomiche sfuggono ai normali controlli cellulari, può verificarsi la carcinogenesi.
La probabilità di sviluppare tumori in pazienti sottoposti a radioterapia per il trattamento del cancro al seno è molto bassa e non può limitare l’uso della radioterapia quando indicata. Dosi di radiazione superiori a 50 Gy inducono la morte cellulare e dosi inferiori (
Numerosi studi hanno suggerito la correlazione tra l’insorgenza di sarcomi dei tessuti molli e i trattamenti di radiazione eseguiti per trattare i tumori al seno. La radioterapia aumenta il rischio di sviluppare sarcomi dei tessuti molli e, in particolare, di sviluppare un angiosarcoma. Il RIAS rappresenta, approssimativamente, meno dell’1% dei tumori del seno. L’angiosarcoma radioindotto ha molte manifestazioni cliniche: I pazienti mostrano spesso cambiamenti cutanei asintomatici che difficilmente possono essere distinti dalle comuni alterazioni attiniche che si possono trovare dopo il trattamento radioterapico sul seno. Le pazienti mostrano spesso un gonfiore palpabile, un’area rosso-violacea simile a un ematoma. Gli angiosarcomi possono essere confusi con manifestazioni benigne come angiomi o teleangectasie atipiche. Possono anche verificarsi papule viola o noduli eritematosi.
Nonostante tutti gli sforzi terapeutici, il tasso di sopravvivenza a cinque anni varia dal 27% al 62,8% (2-3). Anche se la RIAS si sviluppa tipicamente 10 anni dopo i trattamenti radioterapici per il cancro al seno, il periodo di latenza può variare da 6 mesi a 20 anni. L’angiosarcoma radioindotto è indistinguibile dall’angiosarcoma spontaneo, ma si possono valutare alcune differenze: Lae, et al. hanno confrontato l’amplificazione c-myc sul cromosoma 8q24.21 in 32 campioni RASB e 15 campioni di angiosarcoma sporadico.
Nella nostra serie, i pazienti presentavano segni non specifici della malattia, ma la diagnosi è stata fatta prontamente nella maggioranza dei casi. Il periodo di latenza era in accordo con quello riportato in letteratura, con un tempo mediano di 76 anni.
IlRIAS è noto per avere un alto tasso di recidiva. La recidiva locale, sia nel letto del tumore che lungo la cicatrice chirurgica, è segnalata nella maggioranza (96%) dei casi di RIAS. Ciò è probabilmente dovuto alla crescita multifocale della RIAS o ai resti di tessuto maligno dopo l’intervento chirurgico, anche con margini chirurgici negativi. La malattia metastatica, più frequentemente ai polmoni e al fegato, può essere presente contemporaneamente o poco dopo le recidive locali. Abbott et al. hanno rivisto retrospettivamente tutti i casi di RIAS pubblicati a partire dal 2017 e hanno riassunto i dati. Gli autori hanno scoperto che il tasso di recidiva locale era del 59% e che il tempo mediano alla recidiva era di 6 mesi (range, 1-78 mesi). Hanno anche scoperto che la malattia metastatica era di solito preceduta da almeno una recidiva locale e che le sedi più comuni erano i polmoni, il seno controlaterale e lo scheletro. Inoltre, la loro revisione istologica di 42 casi ha suggerito che la RIAS scarsamente differenziata era associata a un alto rischio di metastasi, mentre i tumori ben differenziati presentavano un rischio maggiore di recidiva locale piuttosto che di metastasi a distanza.
Il sarcoma indotto dalle radiazioni è una neoplasia rara ma altamente aggressiva. La sua gestione è una questione di dibattito, perché non sono disponibili linee guida di trattamento, la prognosi è scarsa e il tasso di sopravvivenza a 5 anni varia ampiamente, come riportato in precedenza. Tuttavia, la resezione chirurgica aggressiva è comunemente raccomandata come trattamento di scelta.
La chirurgia, sotto forma di mastectomia con o senza ricostruzione plastica, è il trattamento di scelta nelle pazienti che presentano una malattia localizzata. Nella serie di pazienti in trattamento, è possibile ottenere margini di resezione microscopicamente completi (R0) in più dell’80%. Le RIAS si presentano tipicamente come lesioni multifocali. La tendenza di questa patologia a creare depositi di microsatelliti può contribuire alla difficoltà di ottenere un controllo locale.
L’importanza di eseguire una resezione patologica completa è stata sottolineata in letteratura, anche se non sono state pubblicate linee guida standard riguardanti la distanza di controllo raccomandata. Nella serie attuale, coloro che hanno sviluppato una recidiva locale sono stati trovati ad avere margini più stretti rispetto a quelli che non l’hanno fatto. Tuttavia, lo stato dei margini non è risultato essere indipendentemente prognostico degli esiti oncologici in questa serie. Questo suggerirebbe che la capacità di ottenere margini maggiori dipende da altri fattori biologici del tumore che determinano anche l’esito, come le dimensioni. È probabile che la biologia del tumore sia principalmente responsabile dell’esito nella RIAS, anche se l’intervento chirurgico iniziale dovrebbe mirare alla rimozione macroscopica, si dovrebbe mettere in guardia sul fatto che il raggiungimento di margini negativi maggiori non equivale necessariamente a un miglioramento dell’esito del paziente.
Nonostante il numero crescente di studi che si concentrano sulla chemioterapia e la radioterapia, sia neoadiuvante che adiuvante, il loro ruolo rimane poco chiaro. Mancano dati che dimostrino l’efficacia della chemioterapia adiuvante, dati recenti hanno suggerito che la radioterapia può essere utile nel prevenire le recidive. La radioterapia adiuvante dopo la chirurgia, secondo Johnstone et al. permette un migliore controllo locale. Il ruolo della IMRT nel trattamento della parete toracica è attualmente in fase di valutazione, perché può ridurre il tasso di incidenza della tossicità da radiazioni diminuendo l’irradiazione degli organi a rischio (OAR). In uno studio di confronto dosimetrico, gli autori riferiscono che il piano IMRT alla parete toracica e al bersaglio, rispetto ai trattamenti convenzionali, permette di abbassare la dose massima, aumentare la dose minima, con conseguente migliore conformità e uniformità del volume bersaglio.
Il ruolo e l’efficacia della chemioterapia non sono stati stabiliti in quanto i dati disponibili provengono da gruppi di campioni di piccole dimensioni, da cui non si possono trarre conclusioni definitive, ma probabilmente i pazienti con grado di malignità più elevato, G3 e con recidiva, potrebbero beneficiare maggiormente della chemioterapia neo o adiuvante.
L’uso della chemioterapia neo/adiuvante è stato anche trovato associato a un migliore controllo locale della malattia in una grande serie retrospettiva di pazienti con sarcomi indotti da radiazioni di tutte le sedi, anche se non associato a migliori tassi di ricaduta sistemica o sopravvivenza. La chemioterapia adiuvante non è stata trovata per produrre un beneficio in termini di controllo locale o studio di sopravvivenza globale di sarcomi dei tessuti molli ad alto rischio trattati con chirurgia e radiazioni. Come tale, ci sono prove limitate che suggeriscono che la chemioterapia neo/adiuvante produca un beneficio di sopravvivenza nei RIAS, anche se certamente può essere utile come terapia di induzione prima della chirurgia in quelli che presentano una malattia localmente avanzata e può offrire ai pazienti un’efficace palliazione della malattia in aggiunta. Le terapie mirate possono offrire un trattamento alternativo nei pazienti con malattia progressiva.
Nella nostra serie, come conseguenza dell’alta tendenza alla recidiva locale di questa neoplasia, abbiamo deciso di proporre a tutti i pazienti una seconda irradiazione, tranne uno di loro per i problemi dosimetrici sopra menzionati. Un paziente ha rifiutato la re-irradiazione immediata e il trattamento è stato effettuato alla recidiva. Non è stato possibile programmare un trattamento radiante omogeneo per tutti i pazienti, a causa dell’eterogeneità del campione per le dosi di irradiazione precedentemente utilizzate, della scarsa compliance clinica in un caso e, soprattutto, della mancanza di indicazioni chiare della letteratura e delle linee guida. In ogni caso, abbiamo deciso di erogare il trattamento per mezzo di una tecnica ad intensità modulata, al fine di consentire un’adeguata distribuzione della dose, una riduzione dell’esposizione della dose dei tessuti sani circostanti, soprattutto per il sottostante parenchima polmonare e il cuore.
Conclusioni
La radioterapia nel trattamento del cancro al seno è associata ad un aumento del rischio di successivo sarcoma, ma la percentuale di rischio è molto bassa.
La RRIAS è una lesione rara e aggressiva dei tessuti molli con opzioni di trattamento limitate e un alto tasso di recidiva sia locale che sistemica.
È necessaria un’attenta osservazione dopo la radioterapia adiuvante. Il trattamento standard prevede la chirurgia con mastectomia semplice e radioterapia adiuvante. La chemioterapia può avere un ruolo nel ridimensionamento della malattia localmente avanzata, anche se non ha un effetto dimostrato sulla sopravvivenza.
L’angiosarcoma è significativamente più prevalente nei casi trattati con radioterapia, verificandosi soprattutto all’interno o adiacente al campo di radiazione. La piccola differenza nel rischio di sarcoma successivo per i pazienti con cancro al seno che ricevono la radioterapia non sostituisce il beneficio della radioterapia.
Tuttavia, la nostra serie è troppo piccola per trarre conclusioni definitive e questo è un limite dello studio. Sono necessarie ulteriori valutazioni, anche attraverso un maggior numero di studi di casi, per avere una migliore classificazione della patologia e permettere una gestione multidisciplinare più accurata.
Conflitti di interesse
Nessuno degli autori ha conflitti di interesse da rivelare.
Fonti di finanziamento
Nessuno.
Approvazione etica
L’approvazione è stata data dal comitato etico dell’Università di Catania.
Consenso informato
Il consenso informato scritto è stato ottenuto dal paziente per la pubblicazione di questo case report e delle immagini di accompagnamento. Una copia del consenso scritto è disponibile per la revisione da parte del caporedattore di questa rivista su richiesta.
Contributi degli autori
Trovato Agata: Revisione ed editing dell’articolo.
Registrazione degli studi di ricerca
Nessuno.
Disclosure
Nessuno degli autori ha qualcosa da rivelare.
- Arora TK, Terracina KP, Soong J, Idowu MO, Takabe K (2014) Primary and secondary angiosarcoma of the breast. Gland Surg 3: 28-34.
- Torres KE, Ravi V, Kin K, Yi M, Guadagnolo BA, et al. (2013) Esiti a lungo termine in pazienti con angiosarcomi del seno associati a radiazioni dopo la chirurgia e la radioterapia per il cancro al seno. Ann Surg Oncol 20: 1267-1274.
- Kirova YM, Vilcoq JR, Asselain B, Sastre-Garau X, Fourquet A (2005) Sarcomi indotti dalle radiazioni dopo la radioterapia per il carcinoma mammario: una revisione su larga scala singola istituzione. Cancer 104: 856-863.
- Morgan EA, Kozono DE, Wang Q, Mery CM, Butrynski JE, et al. (2012) Angiosarcoma cutaneo del seno associato alle radiazioni: prognosi infausta in una rara neoplasia secondaria. Ann Surg Oncol 19: 3801-3808.
- Zemanova M, Machalekova K, Sandorova M, Boljesikova E, Skultetyova M, et al. (2013) Gestione clinica dell’angiosarcoma secondario dopo terapia di conservazione del seno. Rep Pract Oncol Radiother 19: 37-46.
- Sheth GR, Cranmer LD, Smith BD, Grasso-Lebeau L, Lang JE (2012) Sarcoma del seno indotto da radiazioni: una revisione sistematica. Oncologist 17: 405-418.
- Huang J, Mackillop WJ (2001) Aumento del rischio di sarcoma dei tessuti molli dopo la radioterapia in donne con carcinoma mammario. Cancer 92: 172-180.
- Seinen JM, Styring E, Verstappen V, Vult von Steyern F, Rydholm A, et al. (2012) Angiosarcoma associato alle radiazioni dopo il cancro al seno: alto tasso di ricorrenza e scarsa sopravvivenza nonostante il trattamento chirurgico con resezione R0. Ann Surg Oncol 19: 2700-2706.
- Jallali N, James S, Searle A, Ghattaura A, Hayes A, et al. (2012) Gestione chirurgica dell’angiosarcoma radioindotto dopo la terapia di conservazione del seno. Am J Surg 203: 156-161.
- Lindet C, Neuville A, Penel N, Lae M, Michels JJ, et al. (2013) Angiosarcomi localizzati: identificazione dei fattori prognostici e analisi dell’impatto del trattamento. A retrospective analysis from the French Sarcoma Group (GSF/GETO) Eur J Cancer 49: 369-376.
- Alvarado-Miranda A, Bacon-Fonseca L, Ulises Lara-Medina F, Maldonado-Martinez H, Arce-Salinas C (2013) Thalidomide combined with neoadjuvant chemotherapy in angiosarcoma of the breast with complete pathologic response: case report and review of literature. Breast Care 8: 74-76.
- Oxenberg J, Khushalani NI, Salerno KE, Attwood K, Kane JM 3rd (2015) Chemioterapia neoadiuvante per l’angiosarcoma primario del tessuto cutaneo/morbido: determinare il comportamento del tumore prima della resezione chirurgica. J Surg Oncol 111: 829-833.
- Strazzanti A, Trovato C, S Gangi, N Pacini, F Basile (2018) Metastasi linfonodali controlaterali in una donna con nuovo tumore primario al seno: Desease sistemica o diffusione locoregionale? Int J Surg Case Rep 53: 400-402.
- Agha RA, Fowler AJ, Saeta A, Barai I, Rajmohan S, et al. (2016) The SCARE Statement: Linee guida per la segnalazione dei casi chirurgici basate sul consenso. Int J Surg 34: 180-186.
- Mery CM, George S, Bertagnolli MM, Raut CP (2009) Sarcomi secondari dopo la radioterapia per il cancro al seno: rischio sostenuto e scarsa sopravvivenza. Cancer 115: 4055-4063.
- Laé M, Lebel A, Hamel-Viard F, Asselain B, Trassard M, et al. (2015) L’amplificazione di c-myc può discriminare in modo affidabile la post-radiazione dall’angiosarcoma primario del seno? Cancer Radiother 19: 168-174.
- Abbott R, Palmieri C (2008) Angiosarcoma del seno dopo la chirurgia e la radioterapia per il cancro al seno. Nat Clin Pract Oncol 5: 727-736.
- Monroe AT, Feigenberg SJ, Mendenhall NP (2003) Angiosarcoma dopo la terapia di conservazione del seno. Cancer 97: 1832-1840.
- Johnstone PA, Pierce LJ, Merino MJ, Yang JC, Epstein AH, et al. (1993) Sarcomi primari dei tessuti molli del seno: controllo locale-regionale con radioterapia post-operatoria. Int J Radiat Oncol Biol Phys 27: 671-675.
- Yang B, Wei XD, Zhao YT, Ma CM (2014) Valutazione dosimetrica del trattamento IMRT integrato della parete toracica e della regione sopraclavicolare per il cancro al seno dopo mastectomia radicale modificata. Med Dosim 39: 185-189.
- Pervaiz N, Colterjohn N, Farrokhyar F, Tozer R, Figueredo A, et al. (2008) A systematic meta-analysis of randomized controlled trials of adjuvant chemotherapy for localized resectable soft-tissue sarcoma. Cancer 113: 573-581.
- Woll PJ, Reichardt P, Le Cesne A, Bonvalot S, Azzarelli A, et al. (2012) Chemioterapia adiuvante con doxorubicina, ifosfamide e lenograstim per il sarcoma dei tessuti molli resecato (EORTC 62931): uno studio randomizzato controllato multicentrico. Lancet Oncol 13: 1045-1054.
- Strazzanti A, Trovato C, Gangi S, Basile F (2018) Casi di tubercolosi al seno in aumento in Sicilia. Int J Surg Case Rep 53: 9-12.
- Spatola C, Tocco A, Milazzotto R, Pagana A, Chillura I, et al. (2016) Ruolo, timing e tecnica della radioterapia nel sarcoma sinoviale pleuropolmonare pediatrico. Future Oncol 12: 73-77.
- Spatola C, Militello C, Tocco A, Salamone V, Raffaele L, et al. (2016) Intensity-modulated radiotherapy for relapsed malignant pleural mesothelioma. Future Oncol 12: 67-71.
- Spatola C, Militello C, Tocco A, Salamone V, Luigi R, et al. (2018) Single-institution experience of intensity-modulated radiotherapy for malignant pleural mesothelioma at University of Catania. Future Oncol 14: 17-21.
Citazione
Strazzanti A, Trovato C, Gangi S, Marletta D, Milazzotto R, et al. (2019) A Single Institution Study Experience of Secondary Breast Angiosarcoma after Breast Conserving Treatment: Gestione multidisciplinare. Int J Cancer Clin Res 6:114. doi.org/10.23937/2378-3419/1410114