Apoptosi

L’apoptosi, o morte cellulare programmata, è un modo altamente regolato per un organismo di eliminare selettivamente le cellule. Questo processo gioca un ruolo importante nell’embriogenesi, nel mantenimento delle dimensioni di un organismo e nell’eliminazione delle cellule danneggiate o aberranti. L’importanza dell’apoptosi nella salute umana è sottolineata dalle molte malattie che derivano dall’apoptosi aberrante. La disregolazione dell’apoptosi è stata collegata a vari tumori, disturbi neurologici e cardiovascolari, e malattie autoimmuni.
Si distingue comunemente tra due diversi tipi di apoptosi: la via intrinseca, mediata dai mitocondri in risposta a stimoli interni come il danno al DNA, e la via estrinseca, mediata da recettori di morte extracellulari (per esempio, il legame di FasL al recettore FasLG) (Figura 1). Entrambe le vie si basano su proteasi chiamate caspasi iniziatrici che attivano una cascata di caspasi effettrici, portando all’apoptosi. La diramazione tra le vie intrinseca ed estrinseca è mediata dall’agonista della morte BH-3 (Bid).
La via intrinseca (Figura 1) è iniziata dalle proteine Bcl-2 homology. Nella via classica dell’apoptosi, le proteine Bcl-2 Bax e Bak sono attivate in risposta a stimoli interni come il danno al DNA o lo stress ossidativo. Queste due proteine interagiscono successivamente con Bid e si inseriscono nella membrana mitocondriale esterna. Questo risulta in quello che è considerato il punto di non ritorno nell’apoptosi – la permeabilizzazione della membrana esterna mitocondriale (MOMP). La MOMP porta al rilascio di fattori pro-apoptotici come il citocromo c nel citoplasma. Il citocromo c nel citoplasma lega APAF-1 e dATP per reclutare la pro-caspasi 9, formando l’apoptosoma. La formazione dell’apoptosoma innesca la scissione della pro-caspasi-9 nella sua forma di proteasi attiva, la caspasi-9. La caspasi-9 è una caspasi iniziatrice che poi attiva le caspasi effettrici a valle, come la caspasi-3 e -7, attraverso la proteolisi, innescando la cascata delle caspasi che porta all’apoptosi.
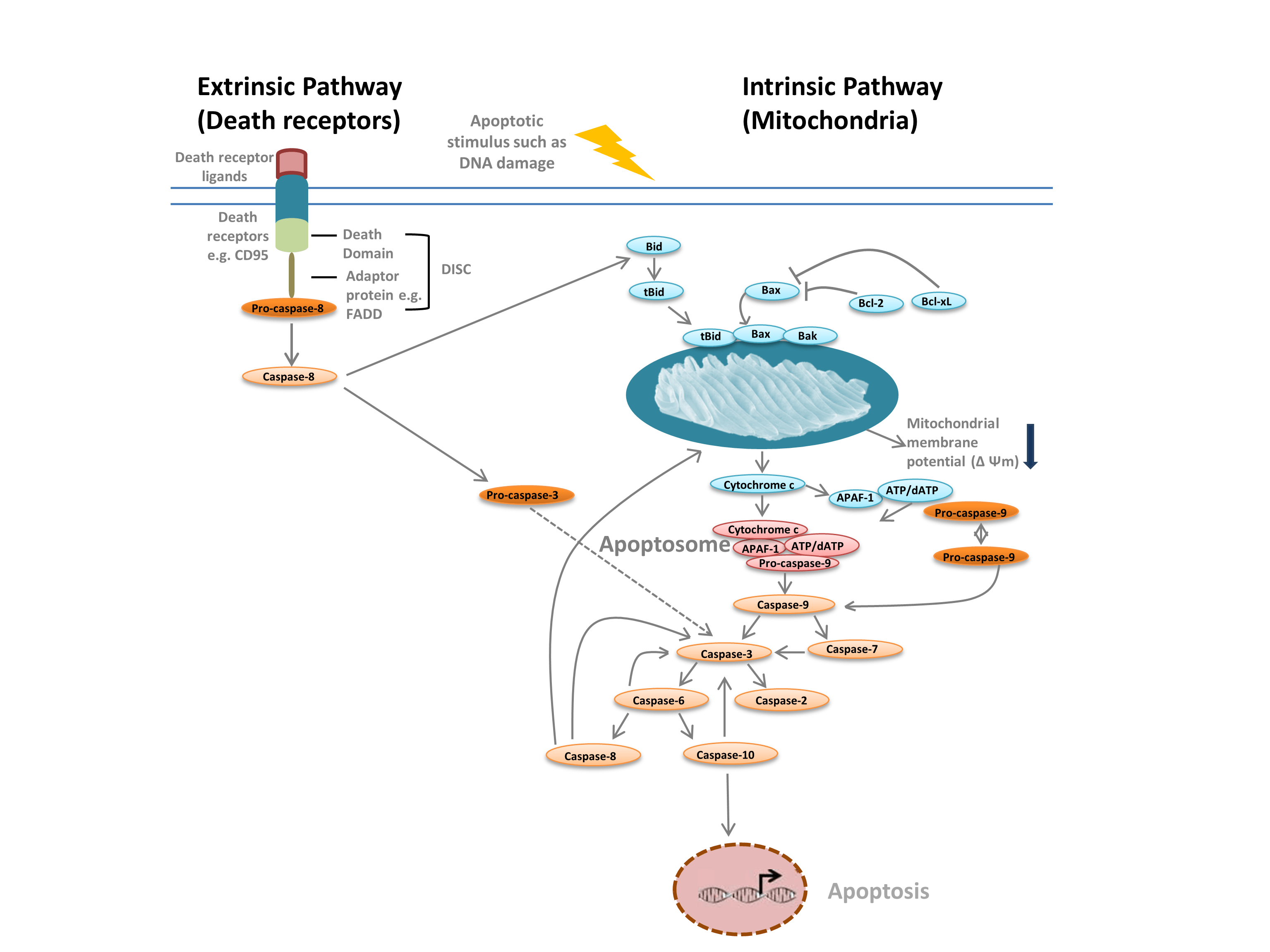
Fig. 1. Le vie dell’apoptosi.
La via estrinseca è innescata dal legame dei ligandi ai recettori della morte. Dopo il legame del ligando, i recettori della morte si oligomerizzano e reclutano proteine adattatrici come FADD. Questo permette il reclutamento della pro-caspasi-8, la forma inattiva della caspasi-8 iniziatrice, e la formazione del complesso di segnalazione che induce la morte (DISC). La pro-caspasi-8 si oligomerizza e viene scissa nella sua forma attiva, la caspasi-8, che a sua volta scinde e attiva l’effettore caspasi-3. La caspasi-3 a sua volta attiva proteoliticamente varie altre caspasi, portando così all’apoptosi. In alcuni casi l’attivazione della via extrinisica può anche portare all’attivazione della via intrinseca, mediata attraverso Bid.
L’apoptosi è distinta dalla morte cellulare non programmata/necrosi. La necrosi è un processo non regolato iniziato da un danno esterno ed è diverso dall’apoptosi in diversi modi chiave (Tabella 1). Tuttavia, poiché abbiamo imparato di più sull’apoptosi e la necrosi e abbiamo identificato nuovi meccanismi di morte cellulare come la necroptosi, le linee tra apoptosi e necrosi sono diventate più confuse. Le caratteristiche distintive delineate nella tabella 1 sono, tuttavia, ancora utili linee guida.
Tabella 1. Caratteristiche dell’apoptosi e della necrosi.
| Apoptosi | Necrosi | |
| Le cellule si restringono | Le cellule si gonfiano | |
| I fagociti/macrofagi fagocitano le cellule | I detriti cellulari vengono rilasciati | . I detriti vengono rilasciati |
| Il processo non è infiammatorio | Il processo è infiammatorio |
È utile dividere questo processo in fasi quando si analizza l’apoptosi:
- L’apoptosi è iniziata e le cascate di segnalazione sono attivate
- Le cellule si restringono e si arrotondano, mediate dalle caspasi
- Gli organelli cambiano forma e le membrane iniziano a sanguinare
- Inizia la condensazione nucleare
- Si può osservare la frammentazione del DNA
- Si formano corpi apoptotici
- I corpi apoptotici vengono fagocitati
Queste fasi apoptotiche, insieme ai mediatori noti dell’apoptosi, possono essere usati come identificatori dell’apoptosi. Quando scegli un test di apoptosi, pensa a quale domanda vorresti porre – i test di attività delle caspasi sono eccellenti indicatori dell’inizio dell’apoptosi mentre i test di frammentazione del DNA possono essere usati per identificare le cellule nelle ultime fasi dell’apoptosi, quando sono irreversibilmente impegnate nella morte cellulare programmata.
Quando si eseguono saggi di apoptosi è sempre saggio includere coloranti di vitalità come lo ioduro di propidio (PI) per differenziare le cellule apoptotiche dalle cellule necrotiche e per ispezionare visivamente le cellule o i tessuti al microscopio per gli indicatori morfologici chiave dell’apoptosi.
Valutare l’apoptosi
1. Cambiamenti morfologici
Il time lapse imaging delle cellule vive può essere usato per seguire l’apoptosi in tempo reale ed è particolarmente utile per identificare il blebbing della membrana. Per i tessuti, la microscopia elettronica a trasmissione può essere usata per identificare molti dei cambiamenti strutturali che accompagnano le fasi dell’apoptosi. I tessuti possono anche essere colorati con ematossilina ed eosina per visualizzare i macrofagi che hanno fagocitato le cellule apoptotiche. L’arancio di acridina (AO) è un altro colorante comunemente usato per visualizzare le cellule apoptotiche. Questo colorante popolare per la vitalità e la proliferazione può essere usato per valutare l’apoptosi perché il suo spettro di emissione diventa arancione quando si trova nell’ambiente acido del lisosoma; questo rende il colorante utile per identificare le cellule apoptotiche fagocitate. I coloranti che legano il DNA come DAPI, Hoechst, ioduro di propidio (PI) e 7-AAD possono essere usati per visualizzare lo sbiancamento nucleare, mentre il restringimento delle cellule può essere rilevato in un citometro a flusso come riduzione della dispersione in avanti (FSC) o visivamente usando la microscopia ottica.
2. Cambiamenti nel potenziale di membrana mitocondriale
I cambiamenti nel potenziale di membrana indicano che una cella ha passato il punto di non ritorno ed è ora impegnata nell’apoptosi. Un crollo del potenziale di membrana mitocondriale può essere rilevato tramite citometria a flusso o immunofluorescenza usando coloranti potenziometrici.
L’estere etilico di tetrametilrhodamina (TMRE), l’estere metilico di tetrametilrhodamina (TMRM) e JC-1 sono coloranti potenziometrici comunemente usati. TMRE e TMRM si aggregano nei mitocondri delle cellule non apoptotiche e diventano di colore arancione o rosso brillante. Nelle cellule apoptotiche con ridotto potenziale di membrana mitocondriale questi coloranti si trovano in tutto il citoplasma nella loro forma monomerica e mostrano una ridotta fluorescenza rossa. I coloranti possono essere usati in combinazione con i saggi di inibizione delle caspasi marcati con fluorofori (FLICA) (vedi sezione successiva) per identificare le cellule apoptotiche sulla base di due caratteristiche: rottura del potenziale di membrana mitocondriale e attivazione delle caspasi (Figura 2).
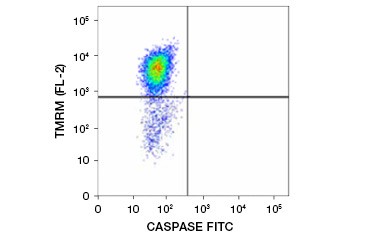
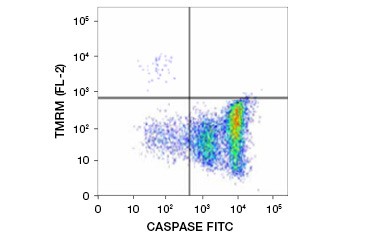
Fig. 2. Rilevazione della riduzione del potenziale di membrana mitocondriale e dell’attivazione della caspasi mediante citometria a flusso. La perdita simultanea di fluorescenza arancione dal TMRM e l’aumento della fluorescenza verde, che mostra l’attivazione della caspasi misurata dal kit FAM-FLICA Polycaspase, mostra le cellule apoptotiche (quadrante in basso a destra).
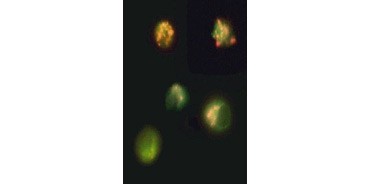
Fig. 3. Rottura del potenziale di membrana mitocondriale visualizzata usando JC-1. Le cellule Jurkat sono state colorate con MitoPT JC-1. Le cellule non apoptotiche (in alto) mostrano mitocondri colorati di rosso mentre le cellule in vari stadi di apoptosi mostrano una fluorescenza citoplasmatica verde.
JC-1 si aggrega anche nei mitocondri delle cellule non apoptotiche e si trova diffuso in tutta la cella nelle cellule apoptotiche. A differenza di TMRE e TMRM , che mostrano una fluorescenza ridotta, JC-1 cambia colore, da rosso a verde. Questo permette di distinguere facilmente le cellule non apoptotiche con fluorescenza rossa da quelle apoptotiche con fluorescenza verde (Figura 3). Questi saggi possono essere letti usando la microscopia a fluorescenza, un citometro a flusso, o un lettore di micropiastre opportunamente equipaggiato.
3. Attivazione della caspasi
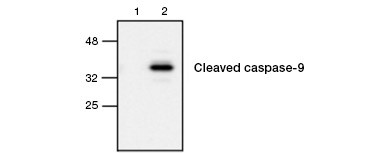
Fig. 4. La caspasi-9 attiva viene rilevata tramite western blot. Analisi western blot di cellule non trattate (corsia 1) e trattate con etoposide (corsia 2) con anticorpo di coniglio anti-caspasi-9 (attivo). La caspasi-9 attiva e scissa viene rilevata solo dopo l’induzione dell’apoptosi con etoposide.
L’attivazione della caspasi è una caratteristica che definisce l’apoptosi. Le caspasi chiave apoptotiche comunemente dosate sono le caspasi iniziatrici 3, 6 e 7 e le caspasi effettrici 2, 8, 9 e 10. L’attivazione delle caspasi può essere identificata sia dalla dimensione ridotta delle pro-caspasi quando vengono scisse, sia usando anticorpi che interagiscono solo con la forma scissa e attivata (Figura 4). Entrambi gli approcci possono essere letti usando il western blotting mentre quest’ultimo approccio può anche essere adattato per saggi di fluorescenza e immunoistochimica scegliendo anticorpi coniugati con fluorofori o biotina. Questi saggi sono compatibili sia con cellule fissate che non fissate.
Una cosa che dovrebbe essere tenuta a mente è che le caspasi iniziatrici sono molto a monte nella via di segnalazione dell’apoptosi e che la loro attivazione non sempre risulta in apoptosi. È quindi saggio accoppiare i saggi per le caspasi iniziatrici con quelli per le caspasi effettrici o, meglio ancora, con sonde per eventi a valle del punto di non ritorno, come il MOMP.
Un’altra classe di saggi di attivazione delle caspasi è costituita da substrati di caspasi marcati con fluorofori, come i FLICA Assays. I FLICA Assays si legano in modo covalente e irreversibile alle caspasi attivate; qualsiasi inibitore non legato si diffonde fuori dalle cellule e/o può essere rimosso con i lavaggi. Questi inibitori sono disponibili fusi a coloranti rossi o verdi. L’intensità della fluorescenza può essere usata come misura quantitativa dell’attività della caspasi – le cellule apoptotiche con un’alta attività della caspasi mostreranno più fluorescenza di quelle con una bassa attività della caspasi. I saggi FLICA sono compatibili con cellule vive, sezioni di tessuto e sezioni sottili congelate, ma non con cellule fissate o tessuti inclusi in paraffina e possono essere letti quantificando l’intensità della fluorescenza utilizzando la microscopia a fluorescenza, la citometria a flusso (Figura 2) o un lettore di micropiastre.
Per trarre conclusioni valide dai saggi di attività della caspasi è sempre saggio scegliere più di un bersaglio.
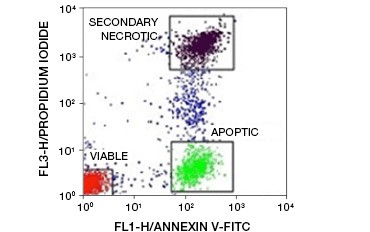
Fig. 5. I coniugati Annexin-V possono essere usati per distinguere le cellule apoptotiche da quelle necrotiche e vitali. Grafico a punti che mostra le cellule di Ramos colorate con annexina V:FITC rispetto allo ioduro di propidio. Si possono osservare tre popolazioni distinte.
4. Esternalizzazione della fosfatidilserina
Una caratteristica chiave dell’apoptosi che è rilevabile anche nelle fasi iniziali è l’esternalizzazione della fosfatidilserina (PS), un fosfolipide presente esclusivamente nella membrana interna delle cellule sane. L’annexina-V lega la fosfatidilserina e i coniugati di annexina-V possono quindi essere utilizzati per valutare l’apoptosi. Questi saggi sono comunemente eseguiti in citometria a flusso utilizzando l’annessoina-V marcata con fluorofori. Combinando questo colorante con qualsiasi colorante di vitalità, come il PI, le cellule apoptotiche possono essere distinte dalle cellule necrotiche. In questi esperimenti di citometria a flusso a due colori tre popolazioni sono facilmente distinguibili: cellule vitali annexin-V/PI doppiamente negative, cellule apoptotiche annexin-V positive/PI negative, e cellule necrotiche secondarie annexin-V/PI doppiamente positive
(Figura 5).
L’esternalizzazione della fosfatidilserina è un processo dinamico e reversibile finché una cellula è impegnata nell’apoptosi dopo MOMP. Usando i coniugati annexin-V è impossibile distinguere le fasi iniziali e reversibili dell’apoptosi dalle fasi successive dell’apoptosi quando una cellula è impegnata nella morte. Le sonde pSIVA (Polarity-sensitive indicator of viability and apoptosis) sono biosensori che legano reversibilmente PS e quindi si accendono e si spengono quando PS passa dalla membrana esterna alla membrana interna (Figura 6). Un altro vantaggio del saggio pSIVA è che, a differenza dei coniugati annexin-V, le sonde pSIVA possono essere aggiunte direttamente alle cellule senza fasi di lavaggio. Questo saggio può essere letto utilizzando la microscopia immunocitochimica e immunofluorescenza, tra cui l’imaging delle cellule vive, che permette un facile confronto delle differenze nei tassi di apoptosi in risposta a diversi trattamenti sperimentali in tempo reale. Poiché l’apoptosi viene monitorata in tempo reale, questo test non è compatibile con le cellule fissate.
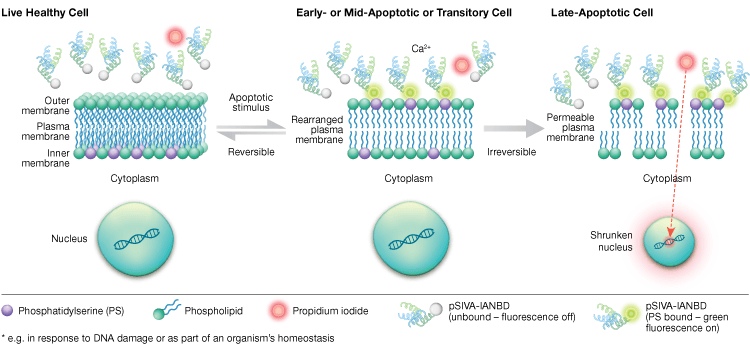
Fig. 6. Il pSIVA Assay può distinguere le cellule vive, apoptotiche precoci e tardive monitorando l’esternalizzazione e l’internalizzazione della fosfatidilserina in tempo reale.
5. Frammentazione del DNA
La frammentazione del DNA è uno degli stadi successivi dell’apoptosi ed è comunemente analizzato tramite il rilevamento del laddering del DNA usando l’elettroforesi basata sull’agarosio o il metodo della deossinucleotidil transferasi terminale dUTP nick end labeling (TUNEL).
Una caratteristica determinante dell’apoptosi è la frammentazione del DNA in frammenti di ~180 bp da parte delle endonucleasi attivate dalla caspasi. Il DNA genomico estratto eseguito su un gel di agarosio mostrerà quindi il caratteristico laddering del DNA non visto in cellule che muoiono per altri meccanismi, come la necrosi.
Il metodo TUNEL è un altro modo di rilevare la creazione di oligonucleosomi da parte dell’endonucleasi attivata dalla caspasi. La scissione del DNA produce gruppi idrossilici 3′ (gruppi 3′-OH). Il test TUNEL utilizza l’enzima deossinucleotidil transferasi terminale (TdT) per aggiungere BrdU a questi gruppi 3′-OH. La BrdU incorporata può quindi essere rilevata utilizzando anticorpi anti-BrdU marcati con biotina o un fluoroforo. Questo test è compatibile con la citometria a flusso, così come l’immunoistochimica e l’immunofluorescenza, e può essere convertito in una lettura radiolabel utilizzando -TdR invece di BrdU. Le cellule devono essere fissate dopo l’incorporazione di BrdU prima della colorazione.
La frammentazione del DNA può anche essere misurata in citometria a flusso usando il saggio sub-G1. I piccoli, ~180 bp, frammenti di DNA generati durante l’apoptosi fuoriescono dalle cellule, diminuendo il contenuto totale di DNA delle cellule apoptotiche. Colorando il DNA con PI, le cellule apoptotiche ipodiploidi possono essere contate nel picco sub-G1 dell’istogramma PI.
6. Pannelli multipli di marcatori di apoptosi
Infine, molti fornitori vendono pannelli per l’analisi immunologica multipla di popolazioni cellulari. Questi pannelli possono testare più marcatori di apoptosi in una volta sola.
A prescindere dal metodo usato per rilevare l’apoptosi, devono essere inclusi controlli appropriati, poiché le condizioni sperimentali e il tipo di cellule possono alterare le prestazioni di alcuni test. Includere sempre controlli positivi e negativi. Includere controlli trattati con veicoli per tenere conto degli effetti dei solventi, controlli specifici per l’applicazione per controllare fattori come l’autofluorescenza negli esperimenti di immunofluorescenza, e controlli di carico per il western blotting.
Tabella 2. Riassunto dei saggi per il rilevamento dei segni distintivi dell’apoptosi.
| Stadio dell’apoptosi | Reagenti per consentire il rilevamento | Applicazione |
| PS flipping | coniugati annexin-V, sonde pSIVA | Citometria a flusso, microscopia |
| Casate di segnalazione iniziate | FLICA, anticorpi caspasi | Citometria a flusso, microscopia, western blot |
| MOMP | TMRM, TMRE, JC-1 | Citometria a flusso, microscopia, lettore micropiastre |
| Riduzione cellulare | Citometria a flusso, microscopia | |
| Sbavatura della membrana | ematossilina + eosina | Microscopia |
| Condensazione nucleare | DAPI, Hoechst, PI, 7-AAD | Microscopia |
| Frammentazione del DNA | TUNEL, saggio Sub-G1, DNA laddering | Gel d’agarosio, citometria a flusso, microscopia |
| Fagocitosi dei corpi apoptotici | Arancio di acridina, ematossilina + eosina | Citometria a flusso, microscopia ottica ed elettronica |