 Veškerá hmota, ať už živá či neživá, se skládá z chemických prvků; ty jsou základními chemickými prvky v tom smyslu, že jsou tím, čím jsou – nelze je změnit na jiný prvek. Každý prvek se vyznačuje počtem protonů
Veškerá hmota, ať už živá či neživá, se skládá z chemických prvků; ty jsou základními chemickými prvky v tom smyslu, že jsou tím, čím jsou – nelze je změnit na jiný prvek. Každý prvek se vyznačuje počtem protonů , neutronů
, neutronů a elektronů
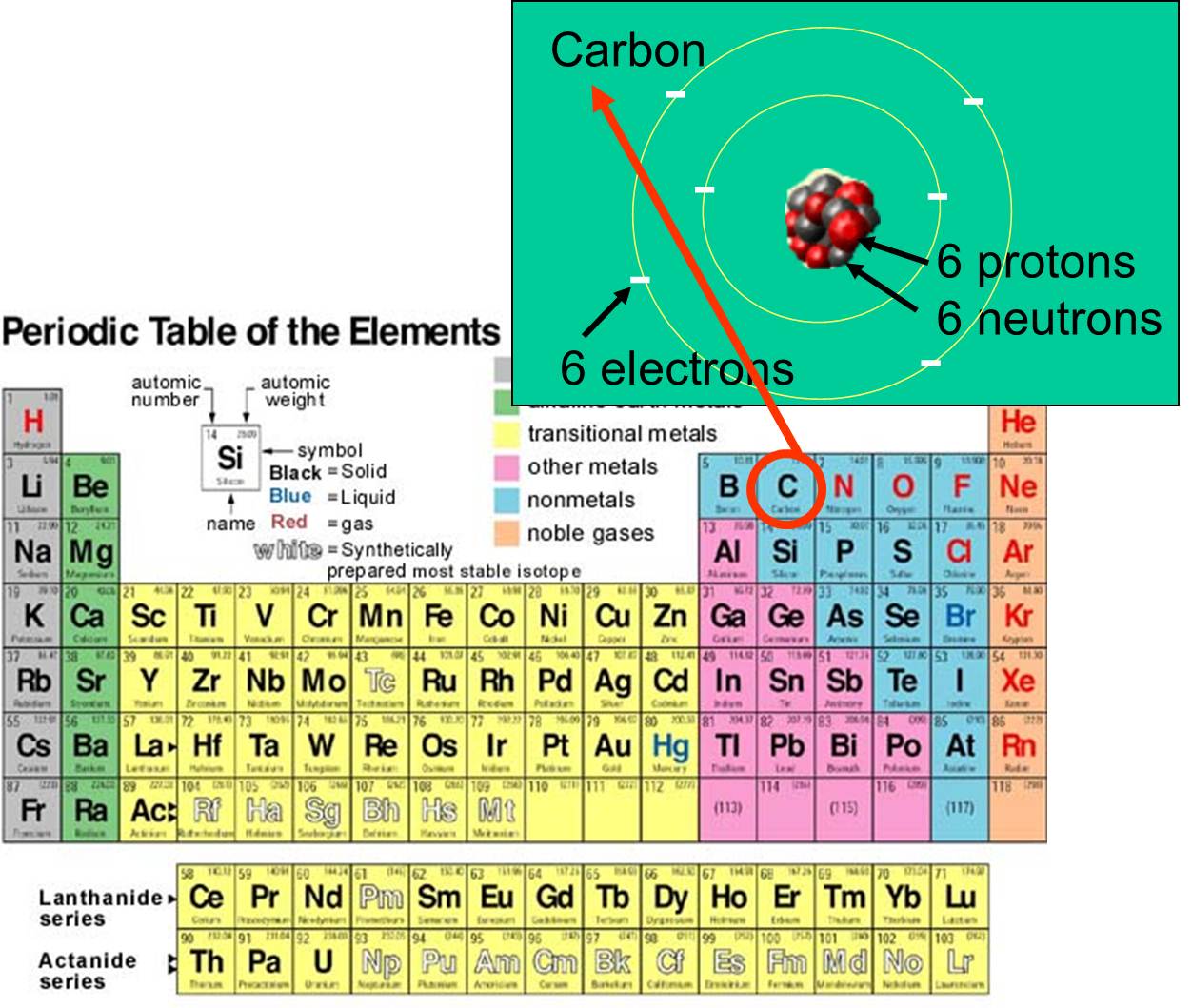
a elektronů , které má. Například atomové číslo uhlíku je 6 a jeho atomová hmotnost je přibližně 12, protože má 6 kladně nabitých protonů a 6 nenabitých neutronů. Šest nabitých elektronů se na atomové hmotnosti podílí jen velmi málo. Na Zemi se v přírodě vyskytuje 92 prvků. Řadu prvků a jejich subatomární strukturu shrnuje periodická tabulka prvků, která je zobrazena vpravo.
, které má. Například atomové číslo uhlíku je 6 a jeho atomová hmotnost je přibližně 12, protože má 6 kladně nabitých protonů a 6 nenabitých neutronů. Šest nabitých elektronů se na atomové hmotnosti podílí jen velmi málo. Na Zemi se v přírodě vyskytuje 92 prvků. Řadu prvků a jejich subatomární strukturu shrnuje periodická tabulka prvků, která je zobrazena vpravo.
V živých organismech jsou nejrozšířenějšími prvky uhlík, vodík a kyslík. Tyto tři prvky spolu s dusíkem, fosforem a hrstkou dalších prvků tvoří naprostou většinu živé hmoty. Atom je jedna jediná jednotka chemického prvku. Některé z těchto prvků, které se hojně vyskytují v organických molekulách, jsou uvedeny níže.
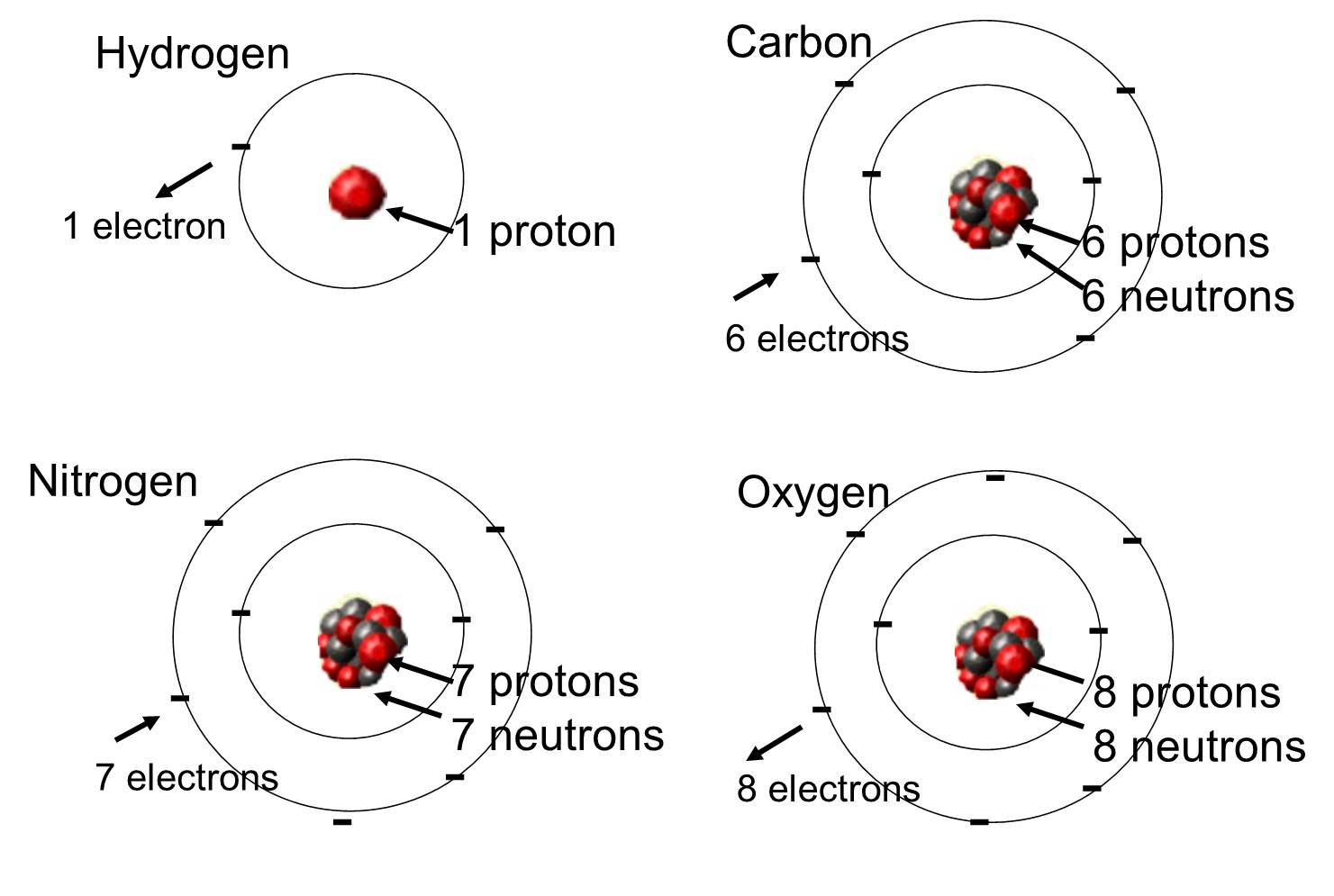
 Atomy se mohou spojovat s jinými atomy vytvářením chemických vazeb.
Atomy se mohou spojovat s jinými atomy vytvářením chemických vazeb.
Kovalentní vazby
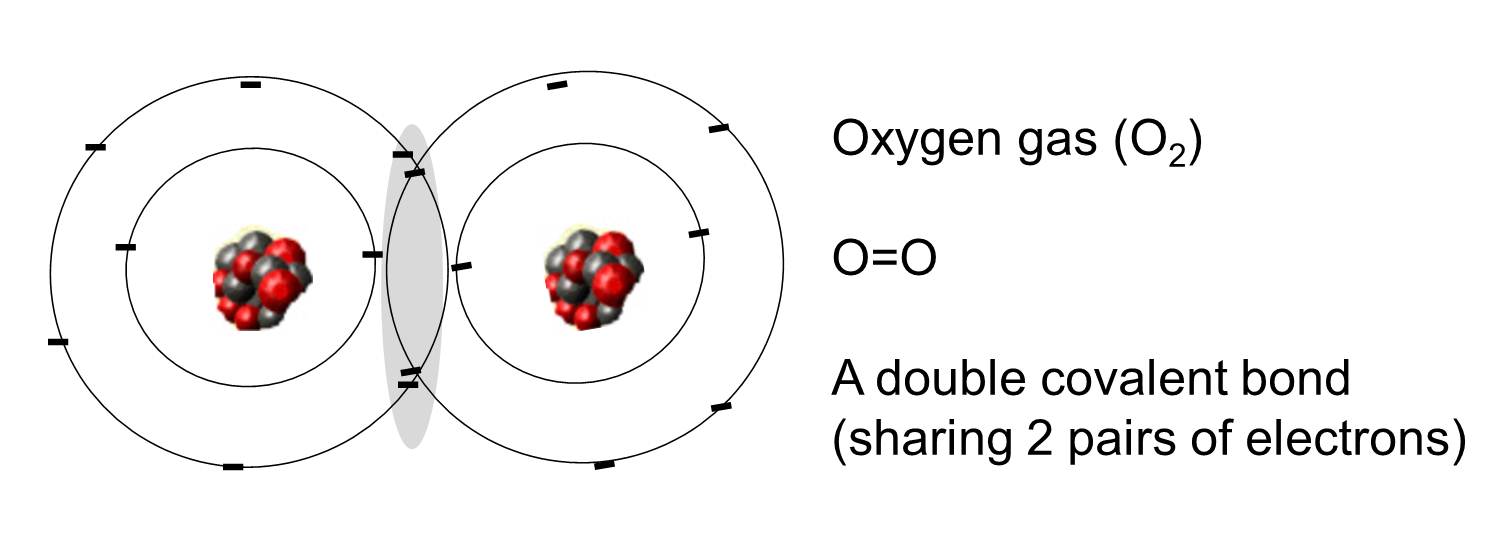
Kovalentní vazba je taková vazba, ve které dva atomy sdílejí jeden nebo více párů elektronů. Obrázek vpravo ukazuje dva atomy kyslíku, které jsou kovalentně vázány sdílením dvou párů elektronů, jak je znázorněno ve stínované oblasti.
Následující obrázek ukazuje řadu molekul vytvořených kovalentní vazbou. Přejeďte myší nad každou molekulou, abyste viděli její stručný popis.
, 
Voda je polární molekula
Všimněte si také, že sdílení elektronů není vždy stejné. Například v molekule vody tráví záporně nabité elektrony více času v blízkosti těžšího atomu kyslíku.
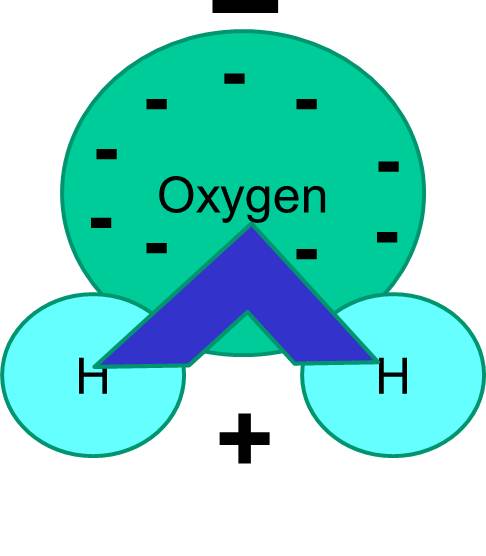
Celkovým výsledkem je, že molekula vody má jeden konec více záporný vzhledem k druhému konci. Voda je tedy „polární“ molekula. Uvidíme, že tato polarita má důležité důsledky pro mnoho biologických jevů včetně struktury buněk. Možná jste už slyšeli výraz „podobné se rozpouští podobně“. Znamená to, že polární molekuly se dobře rozpouštějí v polárních tekutinách, jako je voda. Cukry (např. glukóza) a soli jsou polární molekuly a rozpouštějí se ve vodě, protože kladné a záporné části obou typů molekul se mohou mezi sebou pohodlně rozložit.
Iontové vazby
Sodík má v nejvzdálenějším orbitálním obalu jeden elektron a je termodynamicky stabilnější, pokud se tohoto elektronu vzdá. Výsledkem této ztráty záporného elektronu je kladně nabitý sodný ion, označovaný zkratkou Na+. Chlor má naproti tomu ve své nejvzdálenější orbitální slupce sedm elektronů a je termodynamicky stabilnější, pokud získá další elektron pro doplnění vnější orbitální slupky. Výsledkem je záporně nabitý chloridový ion, označovaný zkratkou Na+. Kladně nabité ionty sodíku a záporně nabité chloridové ionty se vzájemně přitahují a vedou ke vzniku iontové vazby. V nepřítomnosti vody tvoří sodík a chlorid krystalovou mřížku díky přitažlivosti záporných a kladných iontů.
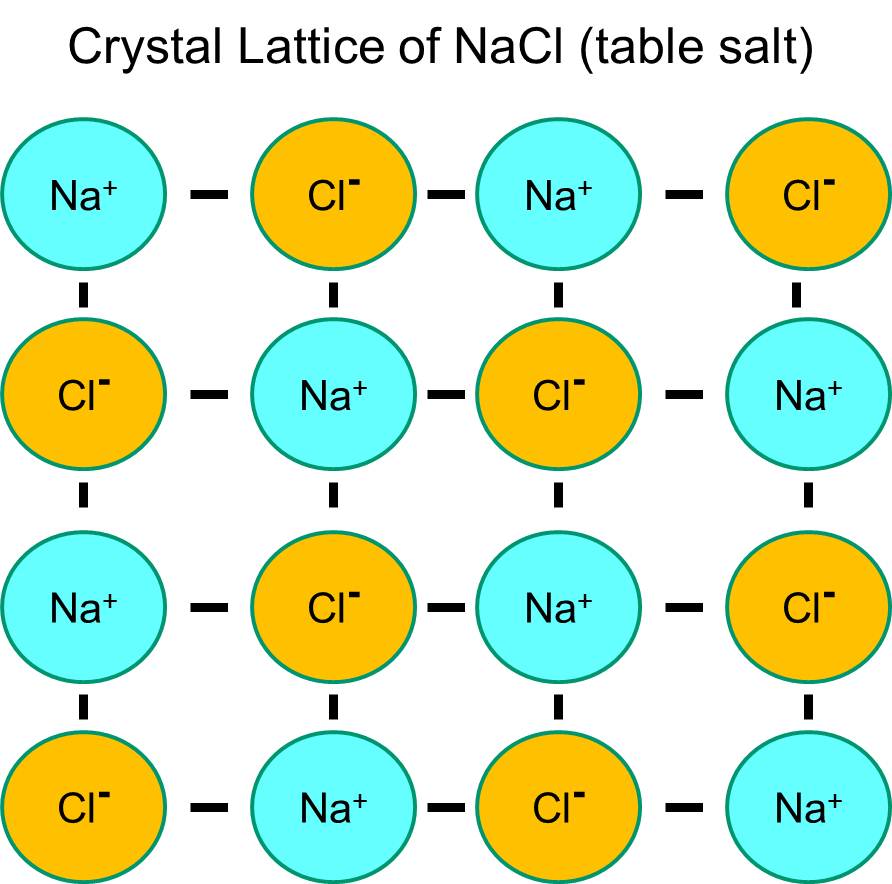
Pokud však krystaly chloridu sodného umístíme do vody, polární molekuly vody atomy sodíku a chloridu „hydratují“, protože molekuly vody jsou polární. Na obrázku níže představují tmavší modré obrazce ve tvaru písmene V molekuly vody, které jsou polární. Kladné konce molekul vody jsou přitahovány záporně nabitými ionty chloridu, zatímco záporný pól molekuly vody je přitahován kladnými ionty sodíku. Výsledkem je hydratace iontů a rozpuštění krystalové mřížky ve vodném roztoku. Přesně to se stane, když do sklenice vody přidáte krystalickou kuchyňskou sůl.
.