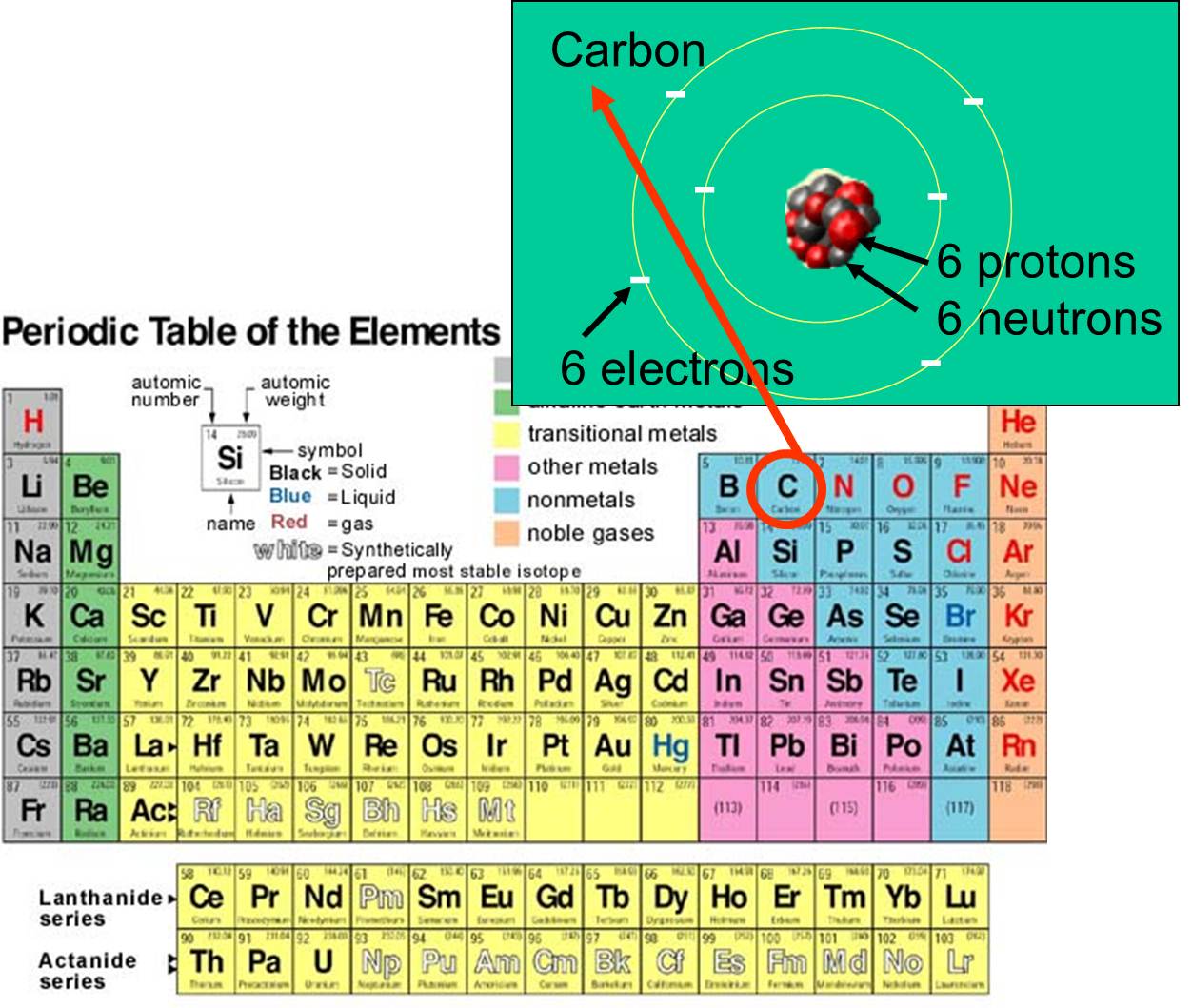
 すべての物質は、それが生きているかどうかにかかわらず、化学元素で構成されている。これらは、それがそれであるという意味で基本的な化学物質であり、別の元素に変化することはない。 各元素は、陽子
すべての物質は、それが生きているかどうかにかかわらず、化学元素で構成されている。これらは、それがそれであるという意味で基本的な化学物質であり、別の元素に変化することはない。 各元素は、陽子 、中性子
、中性子 、電子
、電子 の数によって区別される。 例えば、炭素の原子番号は6で、原子質量は約12である。これは、正の電荷を持つ陽子6個と、電荷を持たない中性子6個を持っているからである。 6個の荷電した電子は原子質量にほとんど寄与していない。 地球上に天然に存在する元素は92種類ある。 元素の配列と素粒子の構造は、右の元素周期表にまとめられています。
の数によって区別される。 例えば、炭素の原子番号は6で、原子質量は約12である。これは、正の電荷を持つ陽子6個と、電荷を持たない中性子6個を持っているからである。 6個の荷電した電子は原子質量にほとんど寄与していない。 地球上に天然に存在する元素は92種類ある。 元素の配列と素粒子の構造は、右の元素周期表にまとめられています。
生物に最も多く含まれる元素は、炭素、水素、酸素です。 この3つの元素と、窒素、リン、および他の少数の元素が、生物体の大部分を占めている。 原子は化学元素の1つの単位である。
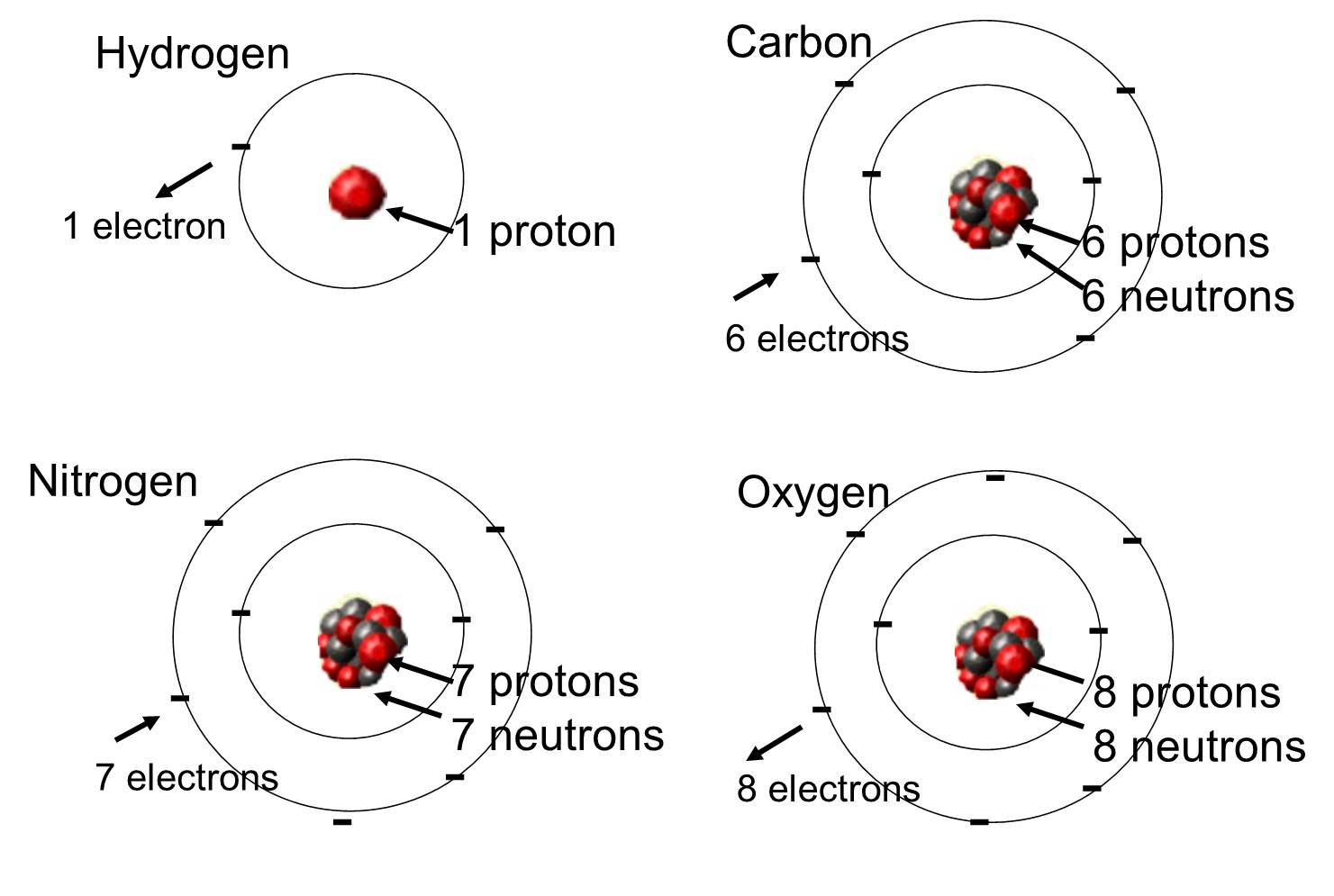
 原子は化学結合を形成して、他の原子と結合することができます。
原子は化学結合を形成して、他の原子と結合することができます。
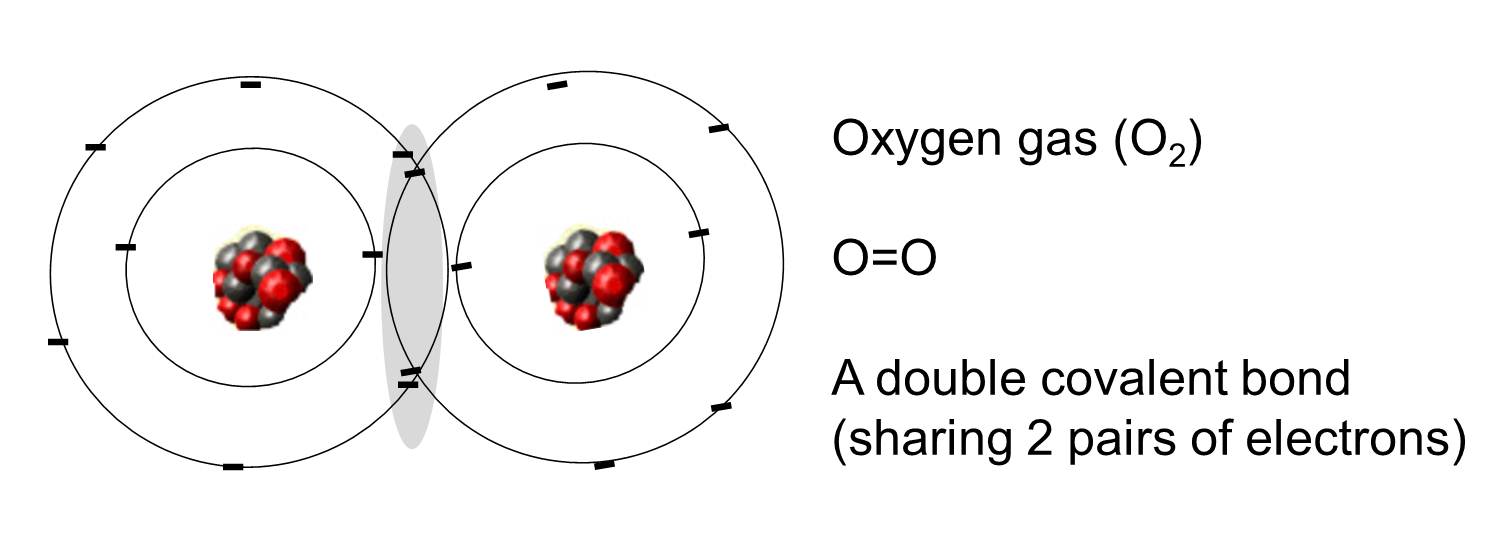
共有結合
共有結合とは、2つの原子で1対以上の電子を共有している結合のことをいいます。 右の図は、斜線で示したように、2つの酸素原子が2組の電子を共有して共有結合しています。
下の図は、共有結合でできた一連の分子を示しています。
, 
Water is a Polar Molecule
また、電子の共有は常に等しいわけではないことに注意してください。 たとえば、水分子の場合、負に帯電した電子はより重い酸素原子の近くでより多くの時間を過ごします。
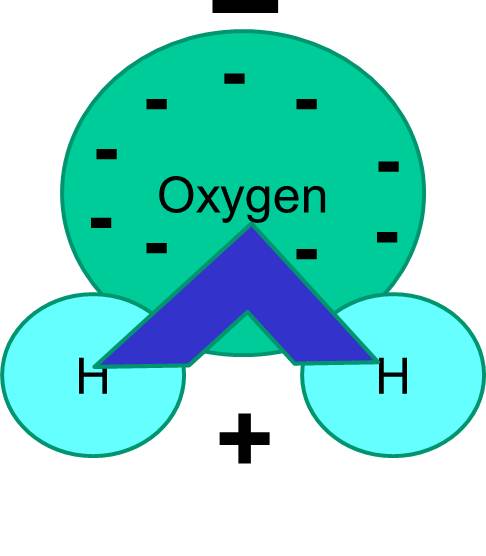
結果として、水分子はもう一方の端に対してより負になっている端を持っています。 したがって、水は「極性」分子である。 この極性が、細胞の構造など多くの生命現象に重要な意味を持つことを理解することができるでしょう。 “類は友を呼ぶ “という言葉を聞いたことがあるかもしれません。 これは、極性分子は水のような極性流体によく溶ける、という意味です。 糖類(グルコースなど)や塩類は極性分子であり、水に溶けるのは、2種類の分子のプラスとマイナスの部分が互いに心地よく分散することができるからなのです。
イオン結合
ナトリウムは最外殻に1個の電子を持っており、この電子を手放した方が熱力学的に安定である。 この負の電子を失うと、正電荷を帯びたナトリウムイオン(Na+)となります。 一方、塩素は最外周の軌道殻に7個の電子を持っていますが、この電子を1個余分に獲得して軌道殻を完成させた方が熱力学的に安定になります。 この結果、負電荷を帯びた塩化物イオン(略称:Na+)が生成される。 正に帯電したナトリウムイオンと負に帯電した塩化物イオンは互いに引き合い、イオン結合を形成する結果となる。 水がないところでは、ナトリウムと塩化物はマイナスイオンとプラスイオンが引き合って結晶格子を形成します。
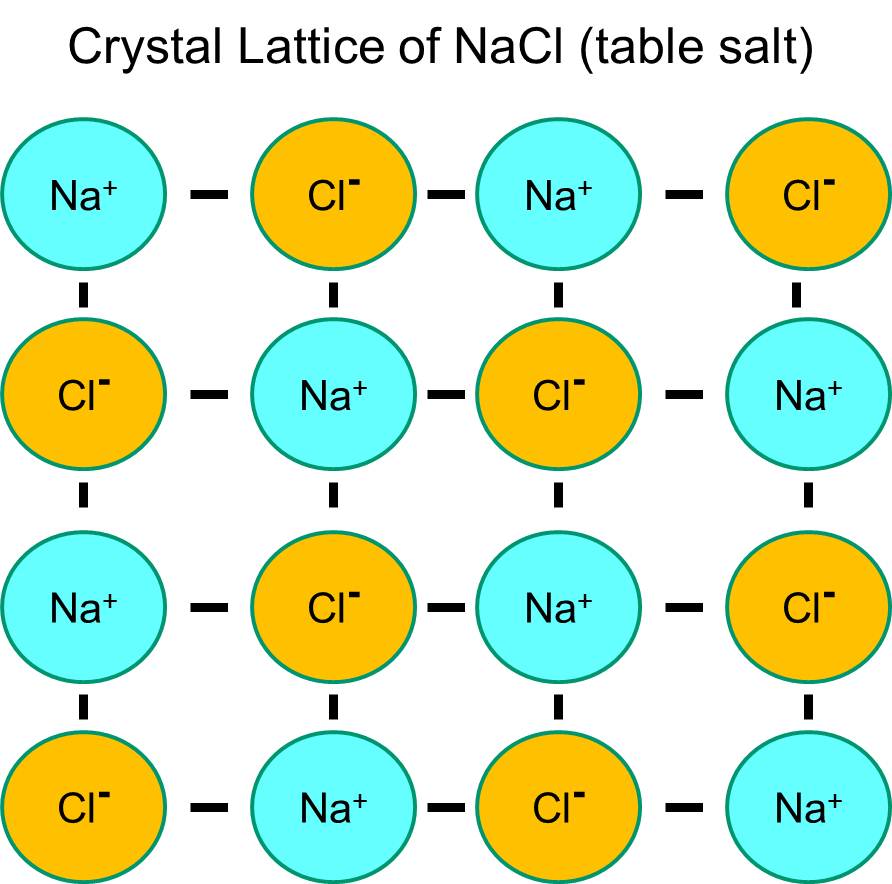
しかし、塩化ナトリウムの結晶を水の中に入れると、水分子が極性をもっているのでナトリウム原子と塩素原子を「水和」させます。 下の図で濃い青色のV字型の図形は水分子を表しており、水分子は極性をもっています。 水分子のプラス極はマイナスに帯電した塩化物イオンに引き寄せられ、マイナス極はプラスに帯電したナトリウムイオンに引き寄せられます。 その結果、イオンは水和し、結晶格子は水溶液に溶け込む。 これはまさに、コップの水に結晶の食卓塩を入れたときに起こる現象です
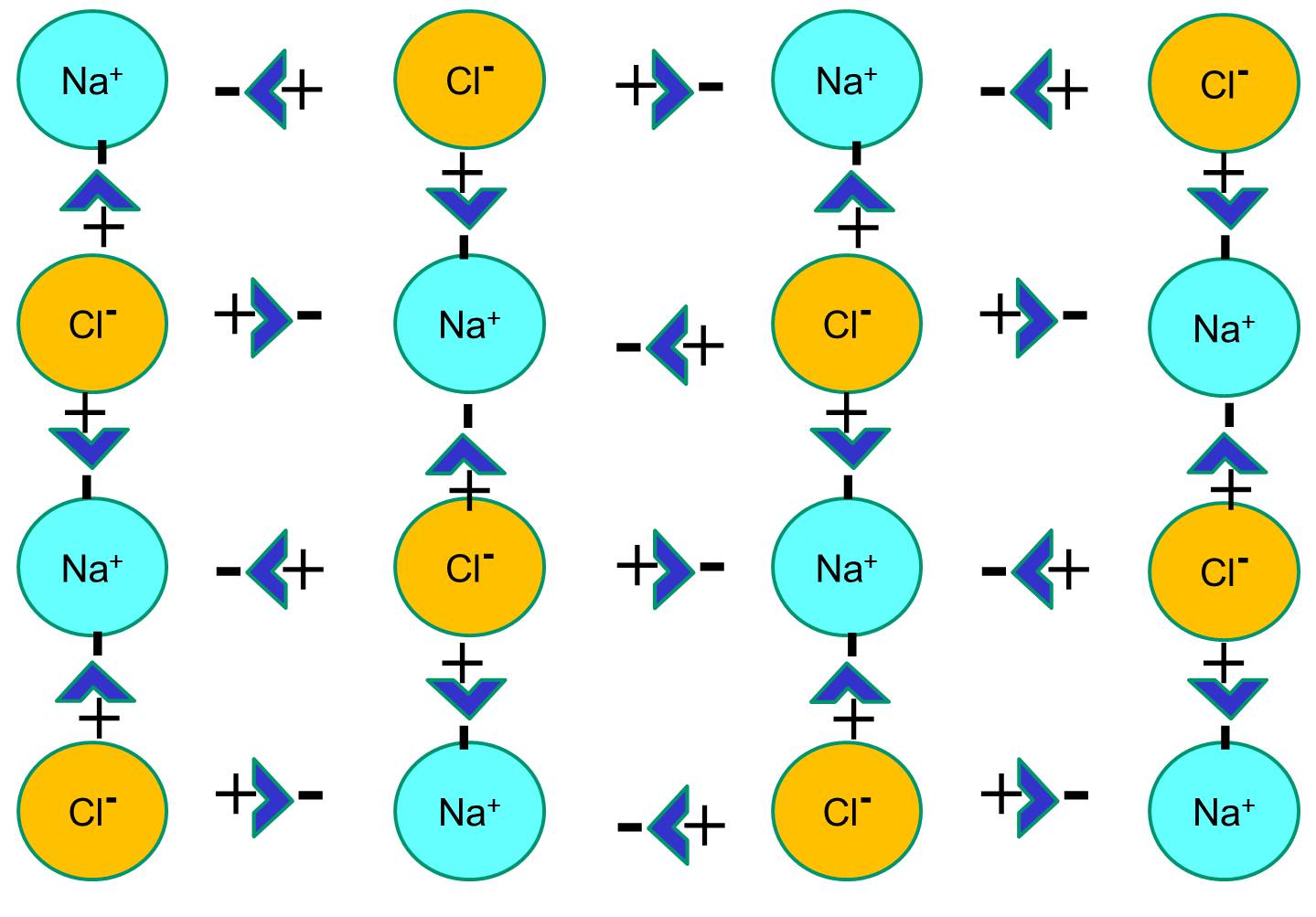
。