 Toată materia, fie că este vie sau nu, este compusă din elemente chimice; acestea sunt elemente chimice fundamentale în sensul că sunt ceea ce sunt – nu pot fi transformate în alt element. Fiecare element se distinge prin numărul de protoni
Toată materia, fie că este vie sau nu, este compusă din elemente chimice; acestea sunt elemente chimice fundamentale în sensul că sunt ceea ce sunt – nu pot fi transformate în alt element. Fiecare element se distinge prin numărul de protoni , neutroni
, neutroni și electroni
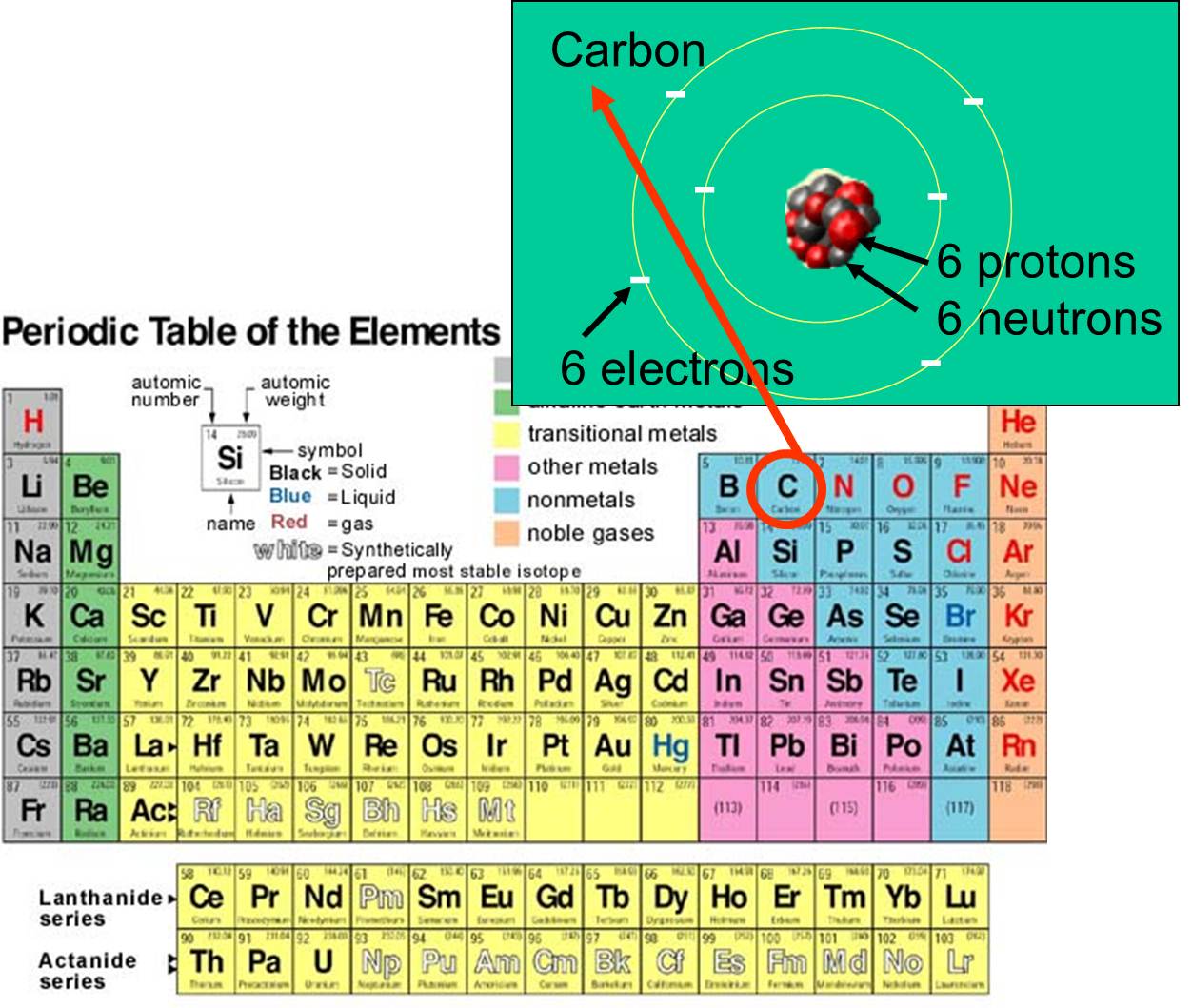
și electroni pe care îi posedă. De exemplu, numărul atomic al carbonului este 6 și are o masă atomică de aproximativ 12, deoarece are 6 protoni încărcați pozitiv și 6 neutroni neîncărcați. Cei 6 electroni încărcați contribuie foarte puțin la masa atomică. Pe Pământ există 92 de elemente care se găsesc în mod natural. Gama de elemente și structura lor subatomică sunt rezumate de tabelul periodic al elementelor, prezentat în dreapta.
pe care îi posedă. De exemplu, numărul atomic al carbonului este 6 și are o masă atomică de aproximativ 12, deoarece are 6 protoni încărcați pozitiv și 6 neutroni neîncărcați. Cei 6 electroni încărcați contribuie foarte puțin la masa atomică. Pe Pământ există 92 de elemente care se găsesc în mod natural. Gama de elemente și structura lor subatomică sunt rezumate de tabelul periodic al elementelor, prezentat în dreapta.
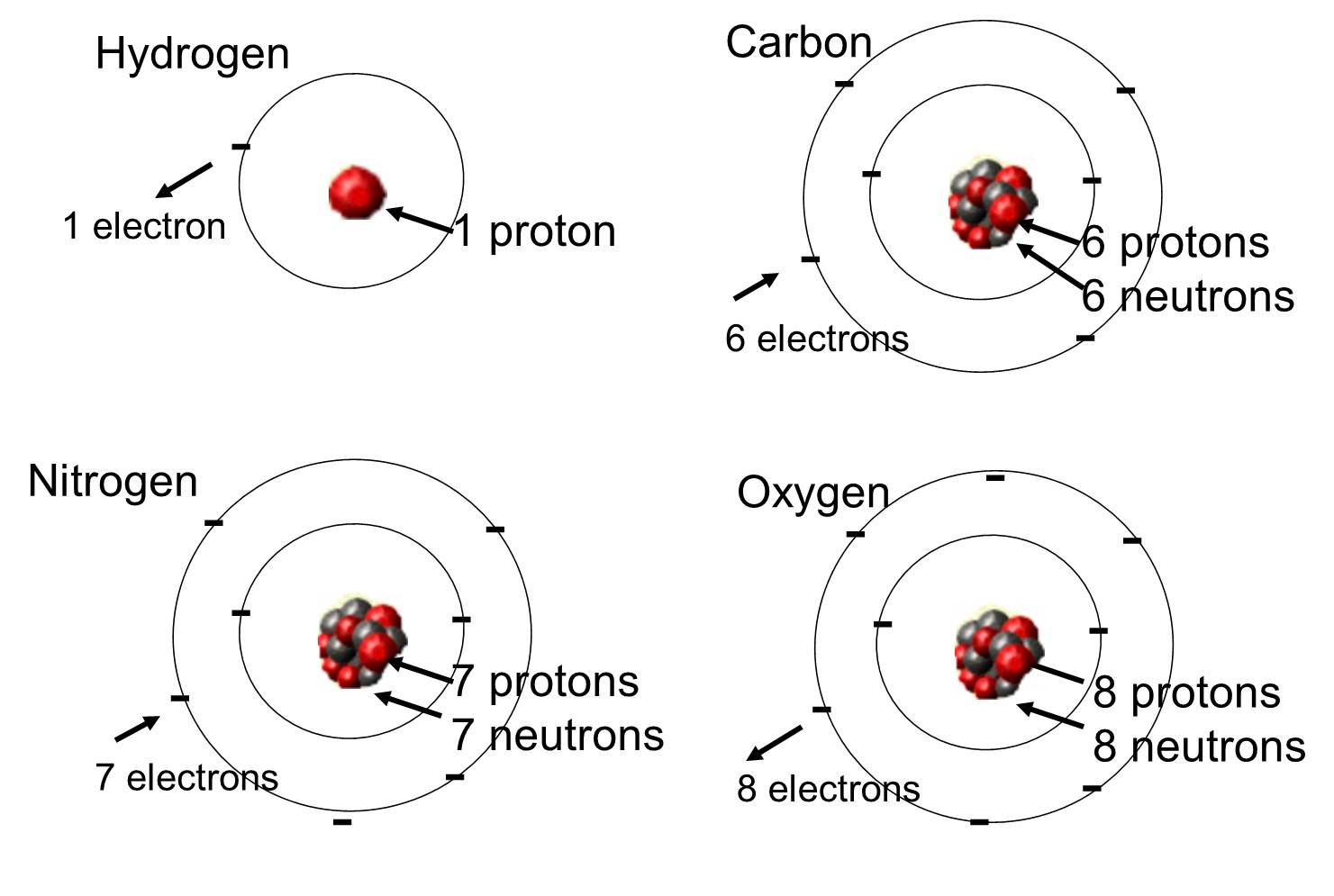
În organismele vii, cele mai abundente elemente sunt carbonul, hidrogenul și oxigenul. Aceste trei elemente, împreună cu azotul, fosforul și o mână de alte elemente, reprezintă marea majoritate a materiei vii. Un atom este o singură unitate a unui element chimic. Unele dintre aceste elemente care sunt abundente în moleculele organice sunt prezentate mai jos.
 Atomii se pot combina cu alți atomi prin formarea de legături chimice.
Atomii se pot combina cu alți atomi prin formarea de legături chimice.
Legături covalente
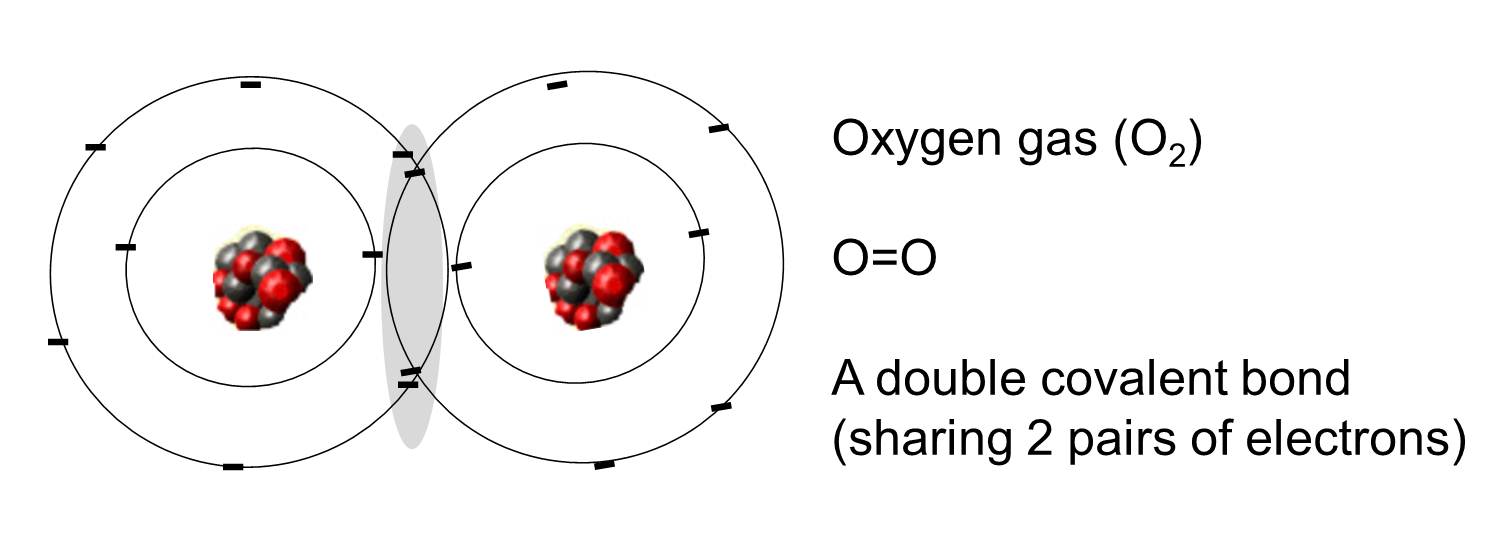
O legătură covalentă este cea în care una sau mai multe perechi de electroni sunt împărțite de doi atomi. Ilustrația din dreapta prezintă doi atomi de oxigen care sunt legați covalent prin partajarea a două perechi de electroni, așa cum este ilustrat în zona umbrită.
Figura de mai jos prezintă o serie de molecule formate prin legătură covalentă. Treceți cu mouse-ul peste fiecare moleculă pentru a vedea o scurtă descriere.
, 
Apa este o moleculă polară
Rețineți, de asemenea, că partajarea electronilor nu este întotdeauna egală. De exemplu, într-o moleculă de apă, electronii încărcați negativ petrec mai mult timp în apropierea atomului de oxigen mai greu.
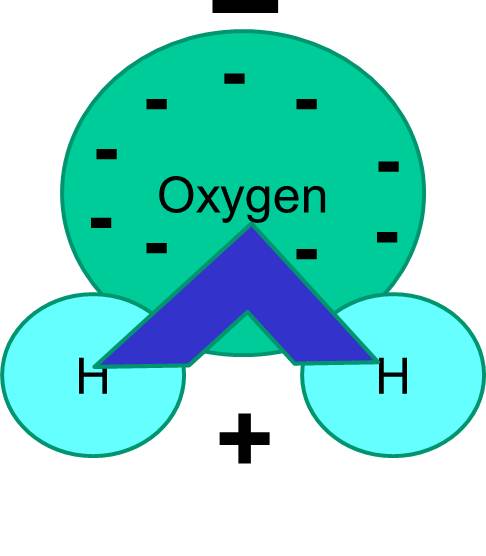
Rezultatul net este că molecula de apă are un capăt care este mai negativ în raport cu celălalt capăt. Apa este, prin urmare, o moleculă „polară”. Vom vedea că această polaritate are implicații importante pentru multe fenomene biologice, inclusiv pentru structura celulară. Este posibil să fi auzit expresia „asemănător se dizolvă asemănător”. Ceea ce înseamnă că moleculele polare se dizolvă bine în fluide polare precum apa. Zaharurile (de exemplu, glucoza) și sărurile sunt molecule polare, iar acestea se dizolvă în apă, deoarece părțile pozitive și negative ale celor două tipuri de molecule se pot distribui confortabil între ele.
Legături ionice
Sodul are un singur electron în învelișul orbital cel mai exterior și este mai stabil din punct de vedere termodinamic dacă cedează acest electron. Această pierdere a unui electron negativ are ca rezultat un ion de sodiu încărcat pozitiv, prescurtat Na+. Clorul, pe de altă parte, are șapte electroni în învelișul orbital cel mai exterior și este mai stabil din punct de vedere termodinamic dacă dobândește un electron suplimentar pentru a completa învelișul orbital exterior. Rezultă astfel un ion clorură încărcat negativ, prescurtat Na+. Ionii de sodiu încărcați pozitiv și ionii de clorură încărcați negativ se atrag reciproc și duc la formarea unei legături ionice. În absența apei, sodiul și clorura formează o rețea cristalină din cauza atracției ionilor negativi și pozitivi.
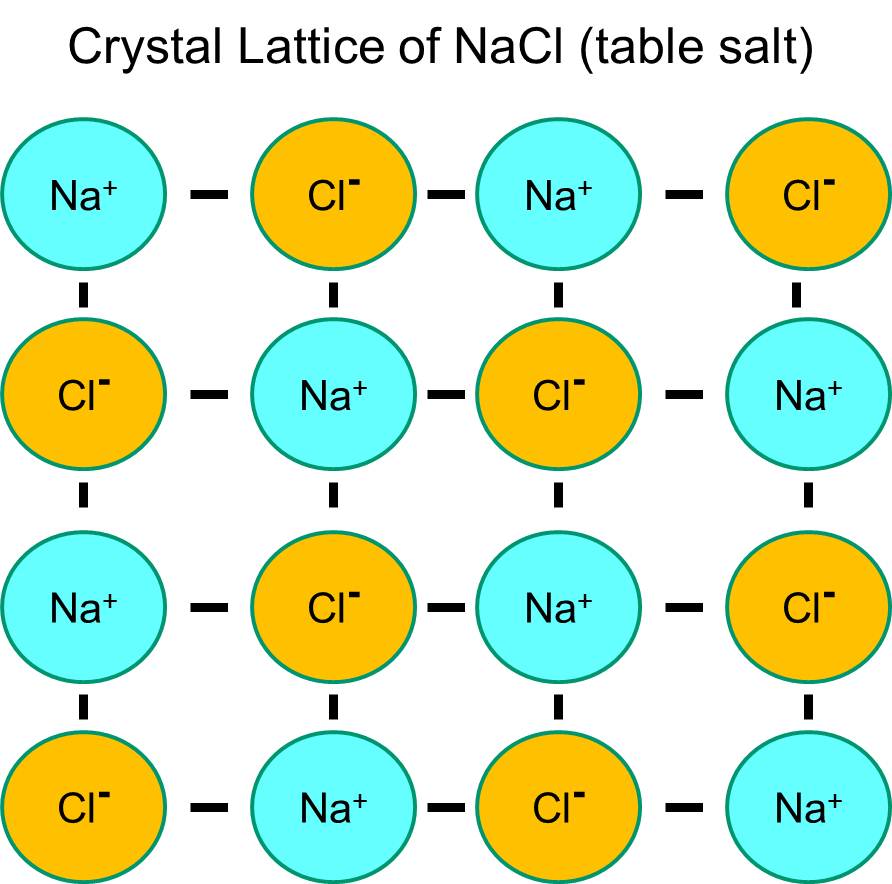
Dar, dacă cristalele de clorură de sodiu sunt plasate în apă, moleculele polare de apă vor „hidrata” atomii de sodiu și clorură, deoarece moleculele de apă sunt polare. În ilustrația de mai jos, figurile în formă de V de un albastru mai închis reprezintă moleculele de apă, care sunt polare. Capetele pozitive ale moleculelor de apă sunt atrase de ionii de clorură încărcați negativ, în timp ce polul negativ al moleculei de apă este atras de ionii pozitivi de sodiu. Ca urmare, ionii sunt hidratați, iar rețeaua cristalină se dizolvă în soluția apoasă. Este exact ceea ce se întâmplă atunci când adăugați sare de masă cristalină într-un pahar cu apă.
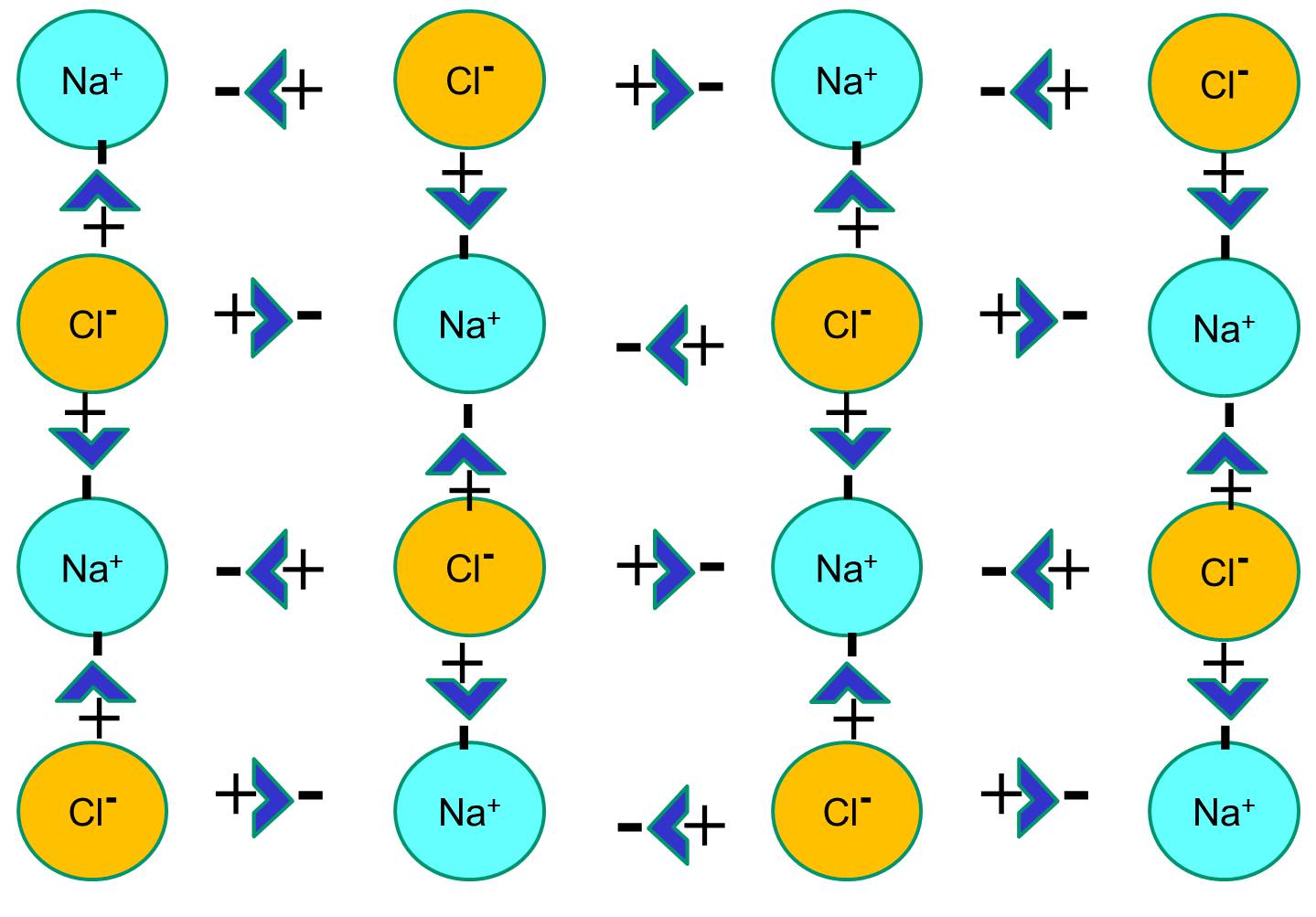
.