Toronto, Ontario (UroToday.com) Michael Chancellor, MD a donné un aperçu du traitement de la vessie atonique (vessie sous-active se manifestant par une difficulté à uriner). Les causes de l’hyperactivité vésicale comprennent :
- Maladie neurologique – Parkinson, diabète, lésion de la moelle épinière et spina bifida.
- Le vieillissement
- Les hommes ayant une hypertrophie de la prostate, et ceux ayant un cancer de la prostate avec les complications thérapeutiques qui en découlent
- Les femmes – après l’accouchement, la ménopause, et après une hystérectomie et un prolapsus pelvien
La sous-activité du détrusor et l’augmentation du volume résiduel post-mictionnel (RPM) sont associées au vieillissement. Environ 22 % des hommes et 11 % des femmes de plus de 60 ans ont des difficultés à vider leur vessie.1 Une autre étude a démontré que la sous-activité du détrusor se retrouve chez 2/3 des personnes âgées incontinentes vivant en institution.2 La figure 2 démontre la prévalence de la difficulté autodéclarée à vider la vessie stratifiée selon le sexe et l’âge.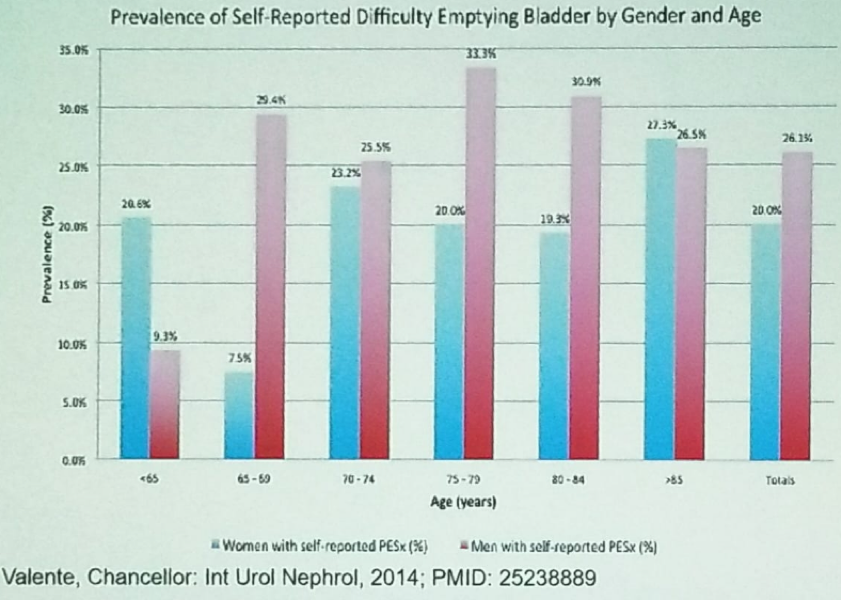
Figure 1- Difficulté autodéclarée à vider la vessie stratifiée selon le sexe et l’âge
L’un des traitements possibles de la vessie sous-active est un cathéter à demeure. Malheureusement, les cathéters sont associés à une myriade de complications, notamment une infection des voies urinaires, une lésion, un rétrécissement et un faux passage de l’urètre, des saignements, une épididymite, des calculs vésicaux et un cancer de la vessie en cas de longues périodes de cathéter à demeure.
Le béthanechol est un carbamate de choline parasympathomimétique qui stimule sélectivement les récepteurs muscariniques anticholinergiques sans effet sur les récepteurs nicotiniques, et dont on a supposé qu’il provoquait la contraction de la vessie et son éventuelle vidange. On a supposé par le passé qu’il s’agissait d’une bonne option de traitement de l’hyperactivité vésicale. Cependant, une méta-analyse portant sur 2 700 patients a démontré que ce médicament ne présentait que peu d’avantages dans le traitement ou la prévention de l’hyperactivité vésicale.3 Les raisons possibles de ce manque d’effet incluent le fait que l’hyperactivité vésicale peut représenter une absence de réponse du muscle détrusor à la neurostimulation. Il faudrait peut-être trouver des agents qui agissent directement sur le muscle lisse du détrusor. Une autre raison possible est que les agents actuels pourraient être sous-dosés pour être efficaces sur le détrusor.
Plusieurs méthodes chirurgicales ont été proposées pour traiter efficacement la vessie hyperactive. Elles agissent sur l’un des deux mécanismes possibles – soit la diminution de la résistance à la sortie, soit l’amélioration de la vidange de la vessie. Les stratégies chirurgicales potentielles visant à diminuer la résistance à la sortie comprennent l’incision du col de la vessie et de la prostate, les procédures visant à vaincre le sphincter externe (surdilatation, sphinctérotomie, pose d’une endoprothèse urétrale), l’injection de toxine botulique dans le sphincter et le plancher pelvien, et la prothèse intra-urétrale avec pompe. Les stratégies chirurgicales qui tentent d’améliorer la vidange de la vessie comprennent la cystoplastie de réduction (réduction de la capacité de la vessie de 80%), la myoplastie vésicale (transfert de muscle), la vessie artificielle (échafaudage biodégradable et ensemencement de cellules) et la thérapie cellulaire (transplantation de cellules souches).
La myoplastie vésicale est principalement réalisée en Allemagne, et consiste à utiliser un lambeau du muscle latissimus dorsi du dos. Dans cette procédure, le muscle latissimus est fixé dans le bassin autour de la vessie, laissant 25% de la vessie non couverte, laissant le trigone et les pédicules latéraux libres. Après avoir enveloppé la vessie avec ce muscle squelettique, des connexions neurovasculaires sont réalisées (figure 2). L’idée sous-jacente est que les patients contractent activement la musculature abdominale inférieure lorsqu’ils veulent uriner. Dans une étude multicentrique portant sur 24 patients suivis pendant 46 mois après avoir subi cette procédure, 16/24 (67%) patients ont retrouvé une miction spontanée sans avoir besoin d’effectuer un cathétérisme intermittent propre (CIC).4
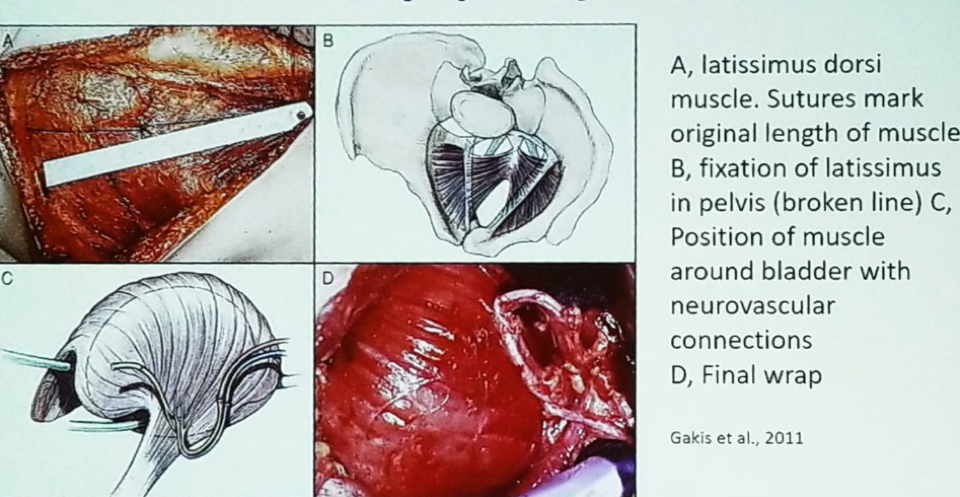
Figure 2- Myoplastie vésicale du muscle Latissimus Dorsi
Le Dr Chancellor a ensuite décrit une nouvelle idée consistant à utiliser une vessie artificielle ensemencée de cellules. La vessie artificielle est anastomosée à la vessie native par des sutures, et l’ensemble de l’implant est recouvert de colle de fibrine et d’épiploon (figure 3). Malheureusement, l’essai de phase 25 impliquant cette technologie, chez des enfants atteints de spina bifida nécessitant une entrocystoplastie, n’a pas donné de résultats favorables, sans amélioration de la capacité ou de la compliance de la vessie, et avec des effets indésirables graves associés.
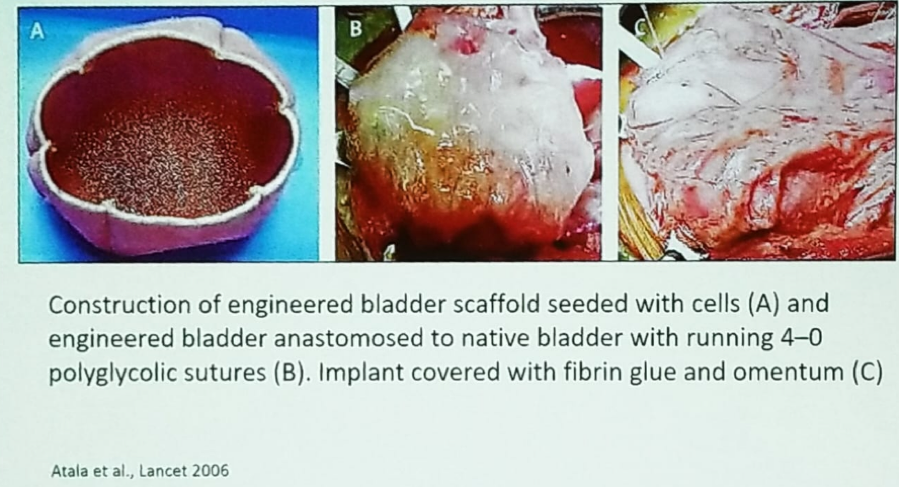
Figure 3 – Engineered bladder
Une autre procédure chirurgicale précédemment mentionnée est l’insertion de la valve-pompe intra-urétrale inflow qui est approuvée par la FDA depuis 2015. Son utilisation est indiquée uniquement chez les femmes présentant une vidange incomplète de la vessie en raison d’une altération de la contractilité du détrusor d’origine neurologique. Malheureusement, le dispositif doit être remplacé tous les mois. Les données ont montré que plus de la moitié des femmes avaient cessé d’utiliser le dispositif en raison de l’inconfort et des fuites d’urine. En outre, les effets indésirables comprenaient des infections des voies urinaires, une inflammation de la vessie, des douleurs, une hématurie, des fuites urinaires, une fréquence et une urgence, et des spasmes de la vessie.
Le Dr Chancellor a ensuite évoqué les recherches et les développements qui ont lieu dans sa propre institution, avec la création d’un laboratoire dédié à la recherche sur la vessie sous-active. Les objectifs de ce laboratoire sont d’identifier des biomarqueurs pour un diagnostic précoce et de valider des modèles précliniques. L’un des essais mis au point par le Dr Chancellor est l’essai clinique sur les cellules souches, qui consiste en une transplantation autologue de cellules dérivées de muscles pour une vessie hyperactive. D’autres projets de recherche comprennent divers modèles animaux pour l’étude de l’hyperactivité vésicale. Enfin, le Dr Chancellor vise à développer un questionnaire spécifique à la vessie hyperactive pour une utilisation clinique.
La vessie hyperactive pourrait partager une voie commune avec la vessie hyperactive. Les deux partagent des symptômes et sont associés à des étiologies sous-jacentes communes telles que le vieillissement, l’obstruction de la sortie de la vessie et le diabète, et les deux peuvent se produire ensemble sous la forme d’une hyperactivité du détrusor avec altération de la contractilité (DHIC). Le Dr Chancellor pense que l’hyperactivité vésicale, l’hyperactivité vésicale sous-jacente et l’hyperactivité vésicale sous-jacente existent toutes dans la même voie commune, l’hyperactivité vésicale finissant par entraîner l’hyperactivité vésicale sous-jacente.
Le Dr Chancellor a résumé son exposé en déclarant qu’il existe actuellement un intérêt accéléré pour la recherche sur l’hyperactivité vésicale sous-jacente, tant myogénique que neurogène. Les modèles animaux montrent que la vessie sous-active démontre souvent que la vessie hyperactive conduit à la DHIC, ce qui entraîne finalement une vessie sous-active. Il y a actuellement plusieurs nouvelles thérapies en développement avec la vessie sous-active représentant un grand besoin non satisfait et une opportunité dans les soins et la recherche en urologie.
Présenté par : Professeur Michael Chancellor, MD Beaumont Health System et Oakland University School of Medicine
1. Diokno AC et al. J Urol 1986 ; 136 : 1022-5
2. Tayloer JA et al. J AM Geriat 2006 ; 54 : 1920-32
3. Barendrecht et al. BJU Int. 2007
4. Gakis et al. J Urol 2011
5. Joseph et al. J Urol 2014
Rédigé par : Hanan Goldberg, MD, Urologic Oncology Fellow (SUO), Université de Toronto, Princess Margaret Cancer Centre, @GoldbergHanan à la 70e section nord-est de l’Association américaine d’urologie (NSAUA) – 11-13 octobre 2018 – Fairmont Royal York Toronto, ON Canada.