Introduction
Vorangegangene Forschungen haben gezeigt, dass Menschen einen Hinweis nutzen können, um sich mental auf eine kognitive Herausforderung vorzubereiten. Wenn die Teilnehmer angewiesen werden, sich in dem Moment geistig vorzubereiten, in dem ein Hinweis präsentiert wird, wurde dies als phasische Wachsamkeit definiert. Die Fähigkeit, den Grad unserer Wachsamkeit zu beeinflussen, könnte von Bedeutung sein, insbesondere wenn Wachsamkeit auch mit Kosten verbunden ist. Wenn die Anforderungen an die Wachsamkeit zu hoch sind, könnte dies zu Müdigkeit (Härmä et al., 2008) oder stressbedingten Problemen führen. In dieser Studie soll untersucht werden, ob und wie gesunde Erwachsene ihre Wachsamkeit auf die erwartete Schwierigkeit einer bevorstehenden kognitiven Aufgabe abstimmen.
Wenn ein Hinweis kurz vor einem Aufgabenreiz präsentiert wird, sind Menschen im Allgemeinen in der Lage, bei einfachen motorischen Reaktionsaufgaben schneller zu reagieren (Fan et al., 2002; Macleod et al., 2010; Weinbach und Henik, 2011) und degradierte visuelle Reize genauer wahrzunehmen (Kusnir et al., 2011). Bildgebende Studien haben gezeigt, dass phasische Wachsamkeit mit einer erhöhten Aktivierung in frontalen, parietalen, thalamischen (Shulman et al., 1999; Fan et al., 2005; Yanaka et al., 2010), temporo-okzipitalen (Thiel et al., 2004) und visuellen Hirnregionen (Bartolucci und Smith, 2011) verbunden ist. Diese bildgebenden Studien haben wertvolle Informationen über die Darstellung der phasischen Wachheit im Gehirn geliefert. Allerdings wurde die phasische Wachheit im Allgemeinen als ein Ein-/Aus-Phänomen untersucht oder die Analyse war auf den visuellen Kortex beschränkt. Daher ist unklar, ob die Wachsamkeit auch die erwartete Schwierigkeit der kognitiven Herausforderung in ganzen Gehirnnetzwerken widerspiegelt.
Außerdem haben frühere Studien darauf hingewiesen, dass die Deaktivierung von Hirnregionen, die Teil des Default Mode Network (DMN) sind, die Ausführung kognitiver Aufgaben erleichtern kann. Erstens zeigen Studien zur Aufgabenausführung, dass ein steigender Schwierigkeitsgrad der Aufgabe mit einer zunehmenden Deaktivierung verbunden ist (McKiernan et al., 2003, 2006; Jansma et al., 2007; Singh und Fawcett, 2008; Pyka et al., 2009; Hedden et al., 2012; Čeko et al., 2015). Zweitens haben Jansma et al. (2007) gezeigt, dass der mediale präfrontale Teil des DMN sich nur auf die Schwierigkeit der Aufgabe einstellt, die der Teilnehmer antizipieren konnte, aber nicht von der tatsächlichen Schwierigkeit der einzelnen Reize beeinflusst wurde, die der Teilnehmer nicht antizipieren konnte. Schließlich fanden Weissman et al. (2006) heraus, dass die Deaktivierung im DMN unmittelbar vor dem Stimulus schwächer war, wenn die Probanden relativ langsam reagierten. Möglicherweise reagierten diese Probanden langsamer, weil sie vorübergehend weniger aufmerksam waren.
Für unsere Studie haben wir eine visuelle Wahrnehmungsaufgabe mit einer leichten und einer schwierigen Bedingung entworfen. Die Hinweise gaben Auskunft über die Schwierigkeit des bevorstehenden Reizes, lieferten aber keine Informationen, die die Aufgabe selbst erleichtern würden. Bei der Hälfte der Versuche folgte auf den Hinweis kein Stimulus. Nur bei diesen Versuchen wurde die Hirnaktivität analysiert, so dass wir die mit dem Hinweis verbundene Aktivierung vollständig von der mit der Aufgabenausführung verbundenen Aktivierung isolieren konnten. Wir stellen die Hypothese auf, dass die Teilnehmer ihre Aktivität auf die erwartete Schwierigkeit der Aufgabe abstimmen.
Materialien und Methoden
Teilnehmer
Die Teilnehmer wurden über eine Online-Anzeige rekrutiert. Teilnehmer wurden ausgeschlossen, wenn sie eine Vorgeschichte mit signifikanten neurologischen oder psychiatrischen Störungen oder Kontraindikationen für die Magnetresonanztomographie (MRT) aufwiesen (Metallgegenstände im oder am Körper, Klaustrophobie oder Schwangerschaft). Diese Studie wurde in Übereinstimmung mit den Empfehlungen des Gesetzes über medizinische Forschung am Menschen (WMO) und der Ethikkommission für medizinische Forschung in Brabant durchgeführt. Das Protokoll wurde von der Ethikkommission für medizinische Forschung genehmigt (Protokollnummer: NL51147.028.14). Alle Probanden gaben ihre schriftliche Einwilligung gemäß der Deklaration von Helsinki.
Zweiundzwanzig gesunde Rechtshänder nahmen an der Studie teil. Die Daten von zwei Teilnehmern wurden aufgrund von Scanner-Artefakten ausgeschlossen. Die Ergebnisse werden für die verbleibenden 20 Teilnehmer berichtet.
Aufgabendesign
Wir entwarfen eine Aufgabe (mit ereignisbezogenem Design), die es uns ermöglichte, Antizipationseffekte in Bezug auf die erwartete Schwierigkeit einer Aufgabe zu untersuchen, ohne störende Effekte bei der Ausführung der Aufgabe.
Die Aufgabenstimuli bestanden aus neun Pfeilen in einer drei mal drei Anordnung auf einem schwarzen Bildschirm (Abbildung 1). Ein „leichter Stimulus“ enthielt acht Pfeile in die richtige Richtung und einen Pfeil in die entgegengesetzte Richtung. Ein „schwieriger Stimulus“ enthielt fünf Pfeile in die richtige Richtung und vier Pfeile in die entgegengesetzte Richtung (Abbildung 1). Die Teilnehmer wurden angewiesen, mit der Hand, die der Richtung der meisten Pfeile entspricht, einen Knopf zu drücken. Leichte und schwierige Stimuli wurden in einer zufälligen Reihenfolge präsentiert. Die Basisstimuli bestanden aus einem stationären schwarzen Bildschirm mit dem Text: „Sie haben 30 Sekunden Pause“ in niederländischer Sprache und weißer Schrift. Die Stimuli wurden mit der Software „Presentation“ präsentiert.
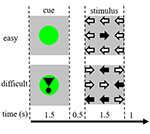
Abbildung 1. Darstellung der visuellen Stimuli. Jeder Trial dauerte 4,5 s. Bei der Hälfte der Trials folgte auf den Cue kein Stimulus. Diese Versuche wurden für die Analyse der funktionellen Magnetresonanztomographie (fMRI) verwendet.
Jeder Versuch begann mit einem Hinweis, der die Schwierigkeit des anschließend präsentierten Reizes angab. Ein grüner Punkt zeigte einen „leichten Reiz“ an, ein grüner Punkt mit einem Ausrufezeichen zeigte einen „schwierigen Reiz“ an (Abbildung 1).
Bei der Hälfte der Versuche folgte auf den Hinweis kein Reiz, bei der anderen Hälfte wurde der Reiz 500 ms nach dem Verschwinden des Hinweises präsentiert. Daraus ergaben sich vier Bedingungen: (1) ein Hinweis auf einen leichten Reiz, auf den kein Reiz folgte („CueE“); (2) ein Hinweis auf einen schwierigen Reiz, auf den kein Reiz folgte („CueD“); (3) ein Hinweis auf einen leichten Reiz, auf den ein leichter Reiz folgte („StimE“); und (4) ein Hinweis auf einen schwierigen Reiz, auf den ein schwieriger Reiz folgte („StimD“). Alle Bedingungen wurden dem Ausgangswert gegenübergestellt. Die Ergebnisse der funktionellen MRT (fMRI) basierten auf CueE und CueD. Die Leistungsergebnisse basierten auf StimE und StimD. CueE und CueD wurden in einer pseudo-randomisierten Reihenfolge unter Verwendung von M-Sequenzen präsentiert, um die Unabhängigkeit der Regressoren des allgemeinen linearen Modells (GLM) zwischen den Bedingungen zu maximieren und die Effizienz des Designs zu optimieren (Buracas und Boynton, 2002). Die Teilnehmer konnten nicht vorhersagen, ob auf einen Cue ein Stimulus folgen würde oder nicht.
Die Dauer eines jeden Trials betrug 4.500 ms. Die Cues wurden bei t = 0 für 1.500 ms und die Stimuli bei t = 2.000, ebenfalls für 1.500 ms, präsentiert (Abbildung 1). Die Aufgabe wurde in zwei Durchläufen von 68 Versuchen durchgeführt. Die Baseline bestand aus drei 30-s-Ruhephasen vor, nach und zwischen den beiden Durchgängen. Die Gesamtdauer der Aufgabe betrug 11,7 Minuten. Dies war die zweite Aufgabe der Sitzung und begann, nachdem die Teilnehmer ca. 10 Minuten im Scanner gelegen hatten.
Die Teilnehmer wurden angewiesen, sich auf einen leichten oder schwierigen Stimulus auf der Grundlage der Informationen des Hinweises (Abbildung 1) vorzubereiten und so genau und schnell wie möglich die Richtung der meisten Pfeile im Stimulus anzugeben. Die Teilnehmer übten die Aufgabe außerhalb des Scanners nach einem Standard-Übungsprotokoll von 3 Minuten. Dieses Protokoll wurde wiederholt, wenn die Leistung unzureichend war (weniger als 70 % Genauigkeit bei den schwierigen Stimuli).
Ein an der Kopfspule angebrachter Spiegel ermöglichte es den Teilnehmern, eine durchsichtige Projektionsfläche hinter dem Kopf zu sehen. Ein Videoprojektor im Scannerraum projizierte die Aufgabenstimuli auf die Leinwand. Zur Aufzeichnung der Antworten wurden zwei pneumatische Druckknopfkästen mit Luftdruck verwendet. Die Teilnehmer benutzten den linken Daumen oder Zeigefinger für die Antwort „links“ und den rechten für die Antwort „rechts“.
Bilderfassung
Scans wurden auf einem 3T Philips Achieva Scanner (Philips Medical Systems, Best, Niederlande) mit einer 32-Kanal SENSE Kopfspule durchgeführt. Für die anatomische Registrierung wurde ein T1-gewichtetes 3D-Strukturbild aufgenommen. fMRI-Bilder wurden mit einer 3D-PRESTO-Pulssequenz gewonnen. Sechs Dummy-Scans wurden aufgenommen und dann vom Scanner verworfen.
Bildvorverarbeitung
fMRI-Daten wurden mit statistischem parametrischem Mapping (SPM12; Wellcome Trust Centre for Neuroimaging, University College London, London, UK2) vorverarbeitet. Die Scans einer Sitzung wurden an den ersten Scan angepasst, um die Bewegungen der Versuchsperson zu korrigieren, wobei ein Ansatz der kleinsten Quadrate, eine räumliche Transformation mit sechs Parametern (Starrkörper) und eine B-Spline-Schätzung zweiten Grades verwendet wurden. Die Scans wurden mit Hilfe eines Starrkörpermodells an T1 koregistriert. Die Parameter wurden anhand der normalisierten gegenseitigen Informationsfunktion geschätzt. Die Bilder wurden mit einem B-Spline 4. Grades neu geschnitten. Die T1 wurde mit einer sehr leichten Bias-Regularisierung (0,0001) und einem B-Spline 4. Grades räumlich in den Standard-MNI-Raum normalisiert. Die resultierenden Parameter wurden auf alle funktionellen Scans angewandt, um anatomische Unterschiede zu minimieren und somit eine Gruppenanalyse zu ermöglichen. Schließlich wurden alle Scans mit einem 3D-Gauß-Filter (volle Breite bei halbem Maximum: 8 mm) räumlich geglättet, um die Auswirkungen funktioneller anatomischer Unterschiede weiter zu minimieren.
Individuelle fMRI-Analyse
Eventbezogene GLM-Regressionsanalyse wurde für jedes Voxel durchgeführt, um individuelle Aktivierungskarten unter Verwendung eines massenunivariaten Ansatzes mit einem globalen approximativen AR(1)-Autokorrelationsmodell und einem Hochpassfilter (128 s Cut-off) zu erstellen. Die Grundlinie wurde nicht explizit modelliert. Die Basisfunktion war eine kanonische HRF ohne Ableitungen. Es wurde eine Maskierungsschwelle von 0,8 verwendet. Für jede Bedingung wurden separate Regressoren verwendet (CueE, 17 Zeitpunkte; CueD, 16 Zeitpunkte; StimE, 17 Zeitpunkte; StimD, 18 Zeitpunkte; und ein Nuisance-Regressor für Leerlaufperioden in der Aufgabe in Bezug auf die m-Sequenz, 68 Zeitpunkte). Es wurden keine Zeitpunkte von der Analyse ausgeschlossen. Die Beta-Karten wurden transformiert, um die tatsächliche prozentuale Signaländerung in jedem Voxel wiederzugeben. Es werden nur die Ergebnisse für die Regressoren CueE und CueD dargestellt, die die Signaländerungen für Cues ohne Stimulus widerspiegeln. Beta- und statistische t-Maps wurden visuell auf größere Artefakte überprüft.
FMRI-Gruppenanalyse
Eine fMRI-Analyse auf zweiter Ebene wurde mit linearer Regression an jedem Voxel zur Visualisierung und Auswahl der Region von Interesse (ROI) durchgeführt. Eine ROI-Analyse wurde mit der GNU Data Language (GDL3) durchgeführt, wobei die von der GLM-Analyse erzeugten Karten der prozentualen Signaländerungen der einzelnen Probanden verwendet wurden. Die Voxel innerhalb einer ROI oder eines Netzwerks wurden gemittelt, um die Signaldifferenz zwischen CueE, CueD und der Grundlinie zu berechnen.
ROI-Auswahl
Supratentorielle lokale Maxima und Minima wurden sowohl für CueE als auch für CueD durch SPM mit einem unkorrigierten Schwellenwert (p < 0,001; Tabelle 1) bestimmt. Kubische ROIs von vordefinierter Größe und Form wurden über die lokalen Maxima für den CueE-Basislinien- und CueD-Basislinien-Kontrast separat innerhalb eines vordefinierten Rasters platziert (Jansma und Rutten, 2017; Tabelle 2). ROIs wurden in die Analyse aufgenommen, wenn sie ein signifikantes lokales Maximum für CueE oder CueD enthielten. Durch die Definition von ROIs auf lokalen Maxima für beide Bedingungen getrennt verhindern wir eine Verzerrung in Richtung CueE oder CueD. Darüber hinaus reduziert die vordefinierte Form und Größe der ROIs innerhalb eines Rasters den Effekt der Zirkularität, da die Grenzen dieser ROIs nicht durch Rauschen beeinflusst werden (Kriegeskorte et al., 2009). Darüber hinaus erleichtert diese Methode den quantitativen Vergleich der Ergebnisse zwischen verschiedenen Bedingungen und möglicherweise zwischen verschiedenen Studien, wodurch die quantitative Reproduzierbarkeit der fMRI-Ergebnisse erleichtert wird. Durch die Platzierung der ROIs über den lokalen Maxima wurde die Leistung optimiert. Es ist jedoch bekannt, dass die Lage des Aktivitätsmaximums durch Rauschen beeinflusst wird, daher kann sich die genaue Lage der ROIs für jeden ROI immer wieder ändern. Dies hat keinen Einfluss auf die Ergebnisse des Netzwerks, da alle ROIs gemittelt werden und die genaue Lage daher nicht so relevant ist.
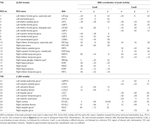
Tabelle 1. Aktivitätsmuster.
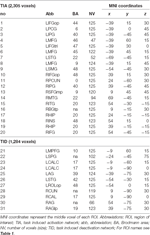
Tabelle 2. Merkmale der Region of Interest (ROI).
ROIs über Regionen mit einer Zunahme der Signaländerung wurden in einem aufgabeninduzierten Aktivierungsnetzwerk („TIA“) zusammengefasst. ROIs über Regionen mit einer Abnahme der Signaländerung wurden in einem aufgabeninduzierten Deaktivierungsnetzwerk („TID“; Tabellen 1, 2) zusammengefasst. Soweit möglich, wurden die ROI-Namen mit Hilfe des AAL-Atlas (Tzourio-Mazoyer et al., 2002) bestimmt.
Tabelle 2 und Abbildung 2 geben einen Überblick über die Größe und Lage aller ROIs. Da die Größe und die Grenzen der ROI vorgegeben sind, ist es möglich, dass sich die durchschnittliche Aktivität in der ROI nicht signifikant von der Basislinie unterscheidet, z. B. weil die Anzahl der aktivierten Voxel innerhalb der ROI relativ gering ist. Obwohl die durchschnittliche Aktivität auf Netzwerkebene für alle Bedingungen signifikant vom Ausgangswert abweicht (Tabelle 3), ist dies für acht der 31 individuellen ROIs für CueE und drei von 31 ROIs für CueD nicht der Fall (Tabelle 4). Nur Voxel, die für jeden Teilnehmer ein Signal enthielten, wurden in die Analyse einbezogen. Die maximale Größe einer ROI beträgt 125 Voxel, einige ROIs umfassen weniger als 125 Voxel, da sie in der Nähe des Schädels positioniert sind.
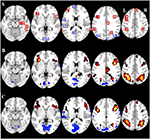
Abbildung 2. Überblick über die Lage der Region of Interest (ROI) und die fMRI-Ergebnisse für das gesamte Gehirn. (A) ROIs für die aufgabeninduzierte Aktivierung (rot) und die aufgabeninduzierte Deaktivierung (blau) Anmerkung: ROI 22 wird nicht angezeigt, da der Ort außerhalb der ausgewählten Schnitte liegt. MNI-Koordinaten, BA-Nummer und Größe der ROIs sind in Tabelle 2 zu finden. (B) Visuelle Darstellung der t-Werte für CueE vs. Baseline (≥3 = rot bis gelb, ≤ -3 = blau bis hellblau), (C) T-Werte für CueD vs. Baseline (≥3 = rot bis gelb, ≤ -3 = blau bis hellblau). Die Bilder sind in neurologischer Orientierung (L = links, R = rechts), Namen, Abkürzungen, MNI-Koordinaten der Spitzenaktivierungsvoxel finden sich in Tabelle 1.

Tabelle 3. Netzwerkergebnisse.
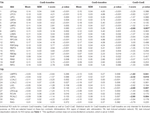
Tabelle 4. ROI-Ergebnisse.
Hypothesentest
In dieser Studie haben wir die folgenden Hypothesen getestet:
Hypothese 1: TIA zeigt eine erhöhte Signaländerung für CueD im Vergleich zu CueE.
Hypothese 2: TID zeigt eine geringere Signaländerung für CueD im Vergleich zu CueE.
Statistische Analyse
Eine Power-Analyse wurde nicht durchgeführt, da den Teilnehmern diese spezielle Aufgabenstellung zum ersten Mal präsentiert wurde. Daher gibt es keine Kenntnisse über die erwartete prozentuale Signalveränderung und die Variabilität der Bedingungen (Desmond und Glover, 2002).
Die Aufgabengenauigkeit wurde für StimE und StimD als Prozentsatz der richtigen Antworten berechnet. Die Reaktionszeiten wurden für StimE und StimD über alle korrekten Antworten berechnet.
Einstichprobenartige t-Tests wurden verwendet, um die prozentuale Signaländerung für TIA und TID im Vergleich zum Ausgangswert für CueE und CueD zu vergleichen. Einseitige t-Tests mit gepaarten Stichproben wurden verwendet, um die Signalveränderung, die Genauigkeit und die Reaktionszeitunterschiede zwischen CueD und CueE zu vergleichen (Hypothese 1 und 2).
Post-hoc-Tests umfassten separate t-Tests für jede ROI innerhalb jedes Netzwerks. Die ROI-Analyse wurde Bonferroni-korrigiert, wenn der Netzwerk-Omnibus-Test nicht signifikant war. Wir präsentieren unkorrigierte p-Werte und einen Kommentar, der angibt, ob dieser p-Wert die Bonferroni-Korrektur für alle Mehrfachvergleiche überstanden hätte. SPSS 24 wurde für alle statistischen Analysen verwendet.
Ergebnisse
Leistung
Die Genauigkeit für die leichten Stimuli („StimE“) betrug 98% ± 1,2% SEM und für die schwierigen Stimuli („StimD“) 85% ± 2,6%. Die Reaktionszeit für StimE betrug 682 ± 20 ms und für StimD 1.138 ± 27 ms. Beide Bedingungen weisen ausreichende Genauigkeitsraten auf, um davon ausgehen zu können, dass die Aufgabe von allen Teilnehmern wie vorgegeben ausgeführt wurde. Wie angenommen, reagierten die Teilnehmer bei StimD weniger genau (T = -4,3, p < 0,001) und langsamer (T = 17,8, p < 0,001) als bei StimE (Abbildung 3), was darauf hindeutet, dass der Kontrast zwischen den leichten und schwierigen Stimuli erfolgreich war.
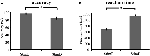
Abbildung 3. Leistungsergebnisse. (A) Genauigkeit für beide Stimuluskategorien, (B) Reaktionszeit für beide Stimuluskategorien. Die Fehlerbalken stellen den Standardfehler des Mittelwerts (SEM) dar. *p ≤ 0.001. Abkürzungen: StimE, ein Cue, der einen leichten Stimulus anzeigt, gefolgt von einem leichten Stimulus; StimD, ein Cue, der einen schwierigen Stimulus anzeigt, gefolgt von einem schwierigen Stimulus.
Funktionelle MRT
Beschreibungen
Das TIA-Netzwerk bestand aus 20 ROIs, von denen 10 auf lokalen Maxima für CueE basierten, fünf auf lokalen Maxima für CueD, und fünf enthielten sowohl ein CueE- als auch ein CueD-Maximum (Tabelle 1). Von diesen 20 ROIs zeigten 19 eine signifikante Aktivität im Vergleich zum Ausgangswert für CueE, 18 für CueD (Tabelle 1). Die durchschnittliche Signaländerung bei TIA im Vergleich zum Ausgangswert betrug für CueE 0,12 ± 0,02 (t = 6,11, p < 0,001) und für CueD 0,12 ± 0,02 (t = 7,61, p < 0,001).
Das TID-Netzwerk bestand aus 11 ROIs, von denen drei auf lokalen Maxima für CueE basierten, sechs auf lokalen Maxima für CueD, und zwei enthielten sowohl ein CueE- als auch ein CueD-Maximum (Tabelle 1). Von diesen 11 ROIs zeigten vier eine signifikante Aktivität im Vergleich zur Baseline für CueE, 10 für CueD (Tabelle 1). Die durchschnittliche Signaländerung in der TID im Vergleich zum Ausgangswert für CueE war -0,07 ± 0,02 (t = 2,68, p < 0,01) und für CueD -0,12 ± 0,02 (t = 5,37, p < 0,001; Tabelle 3).
Abstimmung auf die erwartete Schwierigkeit
Der Signalanstieg in der TIA war für CueD im Vergleich zu CueE nicht signifikant stärker (t = -0,24, p = 0,41), was darauf hindeutet, dass das Niveau der TIA-Aktivierung nicht auf die erwartete Schwierigkeit abgestimmt ist (Abbildung 4, Tabelle 3). Die Post-hoc-ROI-Analyse ergab, dass keine der 20 ROIs innerhalb der TIA nach Anwendung der Bonferroni-Korrektur einen signifikanten Signalanstieg für CueD im Vergleich zu CueE aufwies (Tabelle 4, Abbildung 5).
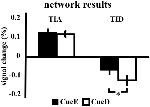
Abbildung 4. Überblick über die Ergebnisse des Netzwerks. Fehlerbalken stellen SEM dar. *p ≤ 0,05 für cue difficult vs. cue easy. Abkürzungen: TIA, aufgabeninduziertes Aktivierungsnetzwerk; TID, aufgabeninduziertes Deaktivierungsnetzwerk; CueE, ein Cue, der einen leichten Stimulus anzeigt, auf den kein Stimulus folgt; CueD, ein Cue, der einen schwierigen Stimulus anzeigt, auf den kein Stimulus folgt.
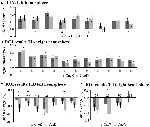
Abbildung 5. Übersicht der individuellen ROI-Reaktionen innerhalb des aufgabeninduzierten Aktivierungsnetzwerks, linke (A) und rechte Hemisphäre (B), und aufgabeninduzierte Deaktivierung, linke (C) und rechte Hemisphäre (D). Fehlerbalken stellen SEM dar. *p ≤ 0,05 für CueD vs. CueE, siehe Abbildung 2 für die Lage der ROIs, siehe Tabelle 1 für die Namen, Abkürzungen und MNI-Koordinaten der ROIs.
Die Signalabnahme der TID war für CueD im Vergleich zu CueE signifikant stärker (T = -2,48, p = 0,01), was darauf hindeutet, dass das Niveau der TID auf die erwartete Schwierigkeit abgestimmt ist (Tabelle 3, Abbildung 4). Die Post-hoc-ROI-Analyse zeigte, dass vier von 11 ROIs der TID eine signifikante Signalabnahme für CueD im Vergleich zu CueE aufwiesen, nämlich LMPFG (T = -1,83, p = 0,04), LSPG (T = -2,32, p = 0,02), LSTG (T = -2,69, p < 0,01) und RCALC (T = -2,90, p < 0,01). Diese Ergebnisse deuten darauf hin, dass die Abstimmung auf die erwartete Schwierigkeit in den linken frontalen, temporalen und visuellen ROIs am stärksten ist (Tabelle 4, Abbildung 5).
Diskussion
In dieser Studie untersuchten wir, ob und wie die phasische Wachheit auf die erwartete Schwierigkeit einer bevorstehenden kognitiven Herausforderung abgestimmt ist. Die phasische Wachsamkeit spiegelte sich sowohl in aktivierten als auch in deaktivierten Hirnregionen wider. Das aktivierte Netzwerk umfasste Regionen des zentralen exekutiven Netzwerks. Das deaktivierte Netzwerk umfasste Regionen des DMN sowie visuelle Kortizes. Das Ausmaß der Deaktivierung skalierte mit der erwarteten Schwierigkeit des bevorstehenden Reizes, das Ausmaß der Aktivierung hingegen nicht. Diese Ergebnisse deuten darauf hin, dass sich die Modulation der phasischen Wachsamkeit vor allem in abgestuften Unterdrückungsprozessen widerspiegelt, die für die aktuelle Aufgabe irrelevant sind (z. B. kardio-vagale, auditive und visuelle Prozesse). Möglicherweise geschah dies, weil diese Prozesse mit bevorstehenden kognitiven Herausforderungen interferieren könnten.
Vorangegangene bildgebende Studien zur phasischen Wachheit verwendeten einen Schwierigkeitsgrad, präsentierten nur aktivierte Hirnregionen (Shulman et al., 1999; Sturm und Willmes, 2001; Thiel et al., 2004; Fan et al., 2005; Périn et al., 2010; Yanaka et al., 2010) oder konzentrierten sich ausschließlich auf die Aktivität im visuellen Kortex (Bartolucci und Smith, 2011). Diese Studien haben ein meist rechts-lateralisiertes fronto-parietal-thalamisches Netzwerk identifiziert, manchmal kombiniert mit motorischen und visuellen kortikalen Regionen, das durch einen Hinweis aktiviert wurde. Bei den aktivierten Netzwerken gibt es zwischen den Studien erhebliche Unterschiede. Einige der Unterschiede zwischen den Netzwerken in früheren Studien lassen sich durch die Aufgabe erklären, die auf den Hinweis folgte. So ermittelten Thiel et al. (2004) mit einer visuellen Wahrnehmungsaufgabe nur eine Aktivierung in visuellen kortikalen Regionen, während Fan et al. (2005) und Yanaka et al. (2010) mit einer motorischen Reaktionsaufgabe eine thalamische und motorische Aktivierung ermittelten. Obwohl Bartolucci und Smith (2011) ein elegantes Cued-Task-Design mit vier Schwierigkeitsstufen für eine Orientierungsunterscheidungsaufgabe vorstellten, präsentierten sie nur die Aktivierung im visuellen Kortex. Es ist daher unklar, wie andere Hirnregionen bei dieser Aufgabe reagierten. Das aufgabeninduzierte Aktivierungsnetzwerk, das in der aktuellen Studie identifiziert wurde, ähnelt am meisten dem Netzwerk, das von Shulman et al. (1999) gefunden wurde, die eine ähnliche Art von visueller Verarbeitungsaufgabe verwendeten.
Es ist unklar, ob phasische Wachsamkeit eine Bottom-up- oder Top-down-Reaktion auf einen uninformativen Hinweis ist (Thiel et al., 2004; Hackley, 2009; Périn et al., 2010; Bartolucci und Smith, 2011; Chica et al., 2016). Phasische Wachsamkeit wurde von einigen als Bottom-up-Reaktion (Sturm et al., 1999; Hackley, 2009), von anderen als Top-down-Reaktion (Bartolucci und Smith, 2011) und von wieder anderen als eine Kombination (Thiel et al., 2004; Périn et al., 2010) betrachtet. Wir argumentieren, dass es am besten geeignet ist, die Reaktion des Gehirns auf einen Hinweis als eine Kombination aus Bottom-up- und Top-down-Verarbeitung zu bezeichnen, da die Teilnehmer sowohl auf einen externen Hinweis als auch auf eine mit diesem Hinweis verbundene Anweisung reagieren. Unsere Hauptergebnisse betreffen jedoch den Unterschied in der Reaktion auf zwei ähnliche Hinweise, die auf eine andere Art von Aufgabenstimulus hinweisen. Daher argumentieren wir, dass der sich ergebende Unterschied zwischen dem Hinweis, der auf eine schwierige Aufgabe hinweist, und dem Hinweis, der auf eine leichte Aufgabe hinweist, eine Ebene der Top-down-Kontrolle darstellen könnte, die mit der Interpretation des Hinweises und der damit verbundenen Anweisung zusammenhängt.
Das aufgabeninduzierte Deaktivierungsnetzwerk umfasste Hirnregionen des DMN, nämlich den medialen präfrontalen Gyrus, die superioren temporalen Gyri und die angulären Gyri (Shulman et al., 1999; Raichle et al., 2001; Raichle, 2015). Es wird allgemein angenommen, dass die Deaktivierung des DMN die Aufgabenleistung fördert, indem interne Prozesse, die kognitive Herausforderungen beeinträchtigen, reduziert werden (Raichle et al., 2001; Buckner et al., 2008; Raichle, 2015). Diese Ansicht wird durch Studien gestützt, die zeigen, dass der Grad der DMN-Deaktivierung mit der Schwierigkeit einer Aufgabe während der Aufgabenausführung skaliert (McKiernan et al., 2003; Singh und Fawcett, 2008). In diesen Studien wurde die Deaktivierung während der Aufgabenausführung untersucht. Unsere Ergebnisse deuten darauf hin, dass diese Skalierung bereits in der Phase der Aufgabenantizipation auftreten kann. Weissman et al. (2006) untersuchten die Variabilität der individuellen Reaktionszeiten, um Aufmerksamkeitslücken zu identifizieren. Die Aufmerksamkeitslücken könnten mit einer verminderten DMN-Deaktivierung verbunden sein. Während (Weissman et al., 2006) die natürliche Variation des Aufmerksamkeitsniveaus untersuchten, deuten unsere Ergebnisse darauf hin, dass die Deaktivierung in mehreren DMN-Regionen auch auf eine Top-down-Art abgestimmt werden kann, bevor der Aufgabenreiz präsentiert wird.
Die tiefgreifendsten Abstimmungseffekte wurden in den linken medialen präfrontalen, temporalen und visuellen Regionen gefunden. Im Folgenden erörtern wir mögliche Implikationen dieser Effekte für diese Regionen in Bezug auf ihre vorgeschlagene Funktion.
Die Aktivität des medialen präfrontalen Kortex wurde zuvor mit Gedankenwanderung (Bertossi et al., 2017), Gedächtnisabruf (Euston et al., 2012) und kardiovagaler Kontrolle (Wong et al., 2007) in Verbindung gebracht. Diese mediale präfrontale Deaktivierung deutet darauf hin, dass eine dieser Funktionen bereits in Erwartung einer kognitiven Herausforderung unterdrückt wird.
Die Abstimmung der Deaktivierung auf die erwartete Schwierigkeit in den visuellen und temporalen Regionen könnte mit der Unterdrückung irrelevanter visueller und auditiver Sinneseindrücke zusammenhängen. Die Abstimmung in den bilateralen temporalen Regionen könnte speziell mit der Unterdrückung des vom MRT-Scanner erzeugten Rauschens zusammenhängen. Es ist davon auszugehen, dass der Geräuschpegel unter den beiden Bedingungen ähnlich ist. Die Tatsache, dass der Grad der Deaktivierung bei den schwierigen Hinweisen stärker ist, deutet darauf hin, dass die Verarbeitung von Umgebungsgeräuschen stärker unterdrückt wird, wenn eine schwierige Aufgabe zu erwarten ist. Über die Deaktivierung in den visuellen Kortizes wird weniger häufig berichtet als über die Deaktivierung in den temporalen Regionen. Smith et al. (2000) haben jedoch zuvor einen Zusammenhang zwischen einer weit verbreiteten Deaktivierung im visuellen Kortex und der Aufmerksamkeit auf einen bestimmten Teil eines Bildes festgestellt. Auch Giesbrecht et al. (2006) berichteten über eine Modulation der visuellen Aktivierung bei verdeckter Aufmerksamkeit auf Objekte in der Nähe des Zentrums ihres Gesichtsfeldes im Vergleich zu Objekten im peripheren Gesichtsfeld. Diese Ergebnisse deuten darauf hin, dass die Aktivierung in den visuellen Kortizes durch verdeckte Aufmerksamkeit auf foveale oder periphere Regionen moduliert werden kann. Unsere Studie fügt diesen Befunden eine neue Dimension hinzu, da sie darauf hindeutet, dass die Aktivierung in den visuellen Kortizes nicht nur durch den Ort der verdeckten visuellen Aufmerksamkeit moduliert wird, sondern auch durch die erwartete Schwierigkeit einer visuellen Herausforderung; und da die Hinweise in Bezug auf Ort und Größe identisch waren, scheint dieser Prozess auf eine Top-down-Weise reguliert zu werden.
Wir identifizierten auch eine Reihe von Hirnregionen, die in Erwartung einer kognitiven Herausforderung eine erhöhte Aktivierung zeigten. Dieses Netzwerk zeigte Ähnlichkeit mit dem zentralen exekutiven Netzwerk, das zuvor mit der Ausführung von Arbeitsgedächtnisaufgaben in Verbindung gebracht wurde (Lawrence et al., 2003). Allerdings war die Aktivierung in diesem Netzwerk nicht auf die erwartete Aufgabenschwierigkeit abgestimmt. Dies deutet darauf hin, dass diese Regionen Prozesse repräsentieren, die für die schwierige und die leichte Bedingung ähnlich sind. Möglicherweise steht die Aktivität in diesem Netzwerk in Zusammenhang mit der Bewertung des Hinweises oder dem Abrufen und Behalten des Aufgabenkontextes und der Anweisungen.
Einige Einschränkungen müssen berücksichtigt werden, die die Interpretation unserer Ergebnisse beeinträchtigen können. Erstens haben wir keine Versuche mit Stimuli aufgenommen, denen kein Hinweis vorausging, so dass es nicht möglich ist, die Wirkung des Hinweises auf die kognitive Leistung zu untersuchen. Aus Zeitgründen war es nicht möglich, die Aufgabe mit identischen Reizen, aber ohne Hinweis zu wiederholen.
Zweitens haben wir ein Ausrufezeichen als Teil des Hinweises auf eine schwierige kognitive Herausforderung verwendet, da dieses Symbol typischerweise verwendet wird, wenn eine erhöhte Aufmerksamkeit erforderlich ist. Es ist möglich, dass das Ausrufezeichen selbst aufgrund seiner inhärenten Bedeutung eine Rolle bei den unterschiedlichen Aktivierungsmustern für die leichte und die schwierige Bedingung gespielt haben könnte. Dies hat jedoch keinen Einfluss auf die Hauptinterpretation unserer Ergebnisse, außer dass unsere Hauptergebnisse als eine Bottom-up-Reaktion und nicht als eine Top-down-Reaktion eingestuft werden können. Schließlich erlaubt unser Versuchsplan nicht zu untersuchen, ob die mit der phasischen Wachheit verbundene Aktivität auf andere Bereiche verallgemeinert werden kann oder ob sie bereichsspezifisch ist, da sie nur eine visuell-perzeptive kognitive Herausforderung beinhaltete.
Zusammenfassend haben wir in dieser Studie gezeigt, dass die Abstimmung der phasischen Wachheit durch das Niveau der Deaktivierung in mehreren Regionen dargestellt wird. Dieser Effekt ist am stärksten im medialen präfrontalen, visuellen und temporalen Kortex, was eine Unterdrückung der kardiovagalen Kontrolle, der visuellen Verarbeitung im peripheren Gesichtsfeld und der Unterdrückung des Rauschens des MRT-Scanners widerspiegeln könnte. Diese Ergebnisse deuten darauf hin, dass die kognitive Leistung durch einen Zustand des Gehirns erleichtert wird, der eng an die Erwartungen hinsichtlich der Schwierigkeit einer bevorstehenden kognitiven Herausforderung gekoppelt ist.
Datenverfügbarkeit
Rohdaten wurden im Elisabeth-Tweesteden-Krankenhaus gewonnen. Abgeleitete Daten, die die Ergebnisse dieser Studie untermauern, sind auf begründete Anfrage beim entsprechenden Autor erhältlich.
Ethikerklärung
Diese Studie wurde in Übereinstimmung mit den Empfehlungen des niederländischen Sozialhilfegesetzes und der medizinischen Ethikkommission Brabant durchgeführt. Alle Probanden gaben ihre schriftliche Einwilligung nach Aufklärung gemäß der Erklärung von Helsinki. Das Protokoll wurde von der medizinischen Ethikkommission Brabant genehmigt.
Beiträge der Autoren
MD und JJ haben das Hauptmanuskript verfasst und die Abbildungen vorbereitet. MD und IS führten die Experimente durch. G-JR, NR und JJ überwachten die Arbeit gemeinsam. Alle Autoren überprüften das Manuskript.
Finanzierung
Diese Studie wurde von ZonMW, einer nationalen niederländischen Organisation (Netherlands Organization for Health Research and Development, ZONMW; Projektnummer: 842003004), finanziert, Projekttitel: Clinical implementation of advanced MRI techniques for localization and monitoring of sensorimotor and cognitive functions in patients with brain tumors.
Conflict of Interest Statement
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Acknowledgments
Wir möchten den Radiologen William Pigmans und Maikel Brands für ihren Beitrag zu dieser Studie danken.
Abkürzungen
DMN, default mode network; M, männlich; F, weiblich; GLM, allgemeines lineares Modell; SPM, statistisches parametrisches Mapping; CueE, ein Cue, der einen leichten Stimulus anzeigt, auf den kein Stimulus folgt; CueD, ein Cue, der einen schwierigen Stimulus anzeigt, auf den kein Stimulus folgt; StimE, ein Cue, der einen leichten Stimulus anzeigt, gefolgt von einem leichten Stimulus; StimD, ein Cue, der einen schwierigen Stimulus anzeigt, gefolgt von einem schwierigen Stimulus; MRI, Magnetresonanztomographie; ROI, region of interest; GDL, GNU data language; TIA, task induced activation network; TID, task induced deactivation network; SEM, standard error of the mean.
Fußnoten
- ^ https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/project-detail/topzorg/clinical-implementation-of-advanced-mri-techniques-for-localization-and-monitoring-of-sensorimotor-a/verslagen/
- ^ http://www.fil.ion.ucl.ac.uk/spm/software/spm12/
- ^ https://github.com/gnudatalanguage/gdl
Bartolucci, M., and Smith, A. T. (2011). Aufmerksamkeitsmodulation im visuellen Kortex wird während des Wahrnehmungslernens verändert. Neuropsychologia 49, 3898-3907. doi: 10.1016/j.neuropsychologia.2011.10.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bertossi, E., Peccenini, L., Solmi, A., Avenanti, A., and Ciaramelli, E. (2017). Transkranielle Gleichstromstimulation des medialen präfrontalen Kortex dämpft die Gedankenwanderung bei Männern. Sci. Rep. 7:16962. doi: 10.1038/s41598-017-17267-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Buckner, R. L., Andrews-Hanna, J. R., and Schacter, D. L. (2008). Das Standardnetzwerk des Gehirns: Anatomie, Funktion und Bedeutung für Krankheiten. Ann. N Y Acad. Sci. 1124, 1-38. doi: 10.1196/annals.1440.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Buracas, G. T., and Boynton, G. M. (2002). Effizientes Design von ereigniskorrelierten fMRI-Experimenten mit M-Sequenzen. Neuroimage 16, 801-813. doi: 10.1006/nimg.2002.1116
PubMed Abstract | CrossRef Full Text | Google Scholar
Čeko, M., Gracely, J. L., Fitzcharles, M. A., Seminowicz, D. A., Schweinhardt, P., and Bushnell, M. C. (2015). Ist ein reaktionsfähiges Standardmodus-Netzwerk für die erfolgreiche Ausführung von Arbeitsgedächtnisaufgaben erforderlich? J. Neurosci. 35, 11595-11605. doi: 10.1523/JNEUROSCI.0264-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Chica, A. B., Bayle, D. J., Botta, F., Bartolomeo, P., and Paz-Alonso, P. M. (2016). Interaktionen zwischen phasischer Alarmierung und Bewusstsein im fronto-striatalen Netzwerk. Sci. Rep. 6:13. doi: 10.1038/srep31868
PubMed Abstract | CrossRef Full Text | Google Scholar
Desmond, J. E., and Glover, G. H. (2002). Schätzung der Stichprobengröße in funktionellen MRI (fMRI) Neuroimaging-Studien: statistische Leistungsanalysen. J. Neurosci. Methods 118, 115-128. doi: 10.1016/s0165-0270(02)00121-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Euston, D. R., Gruber, A. J., and McNaughton, B. L. (2012). Die Rolle des medialen präfrontalen Kortex bei Gedächtnis und Entscheidungsfindung. Neuron 76, 1057-1070. doi: 10.1016/j.neuron.2012.12.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Fossella, J., Flombaum, J. I., and Posner, M. I. (2005). Die Aktivierung von Aufmerksamkeitsnetzwerken. Neuroimage 26, 471-479. doi: 10.1016/j.neuroimage.2005.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Sommer, T., Raz, A., and Posner, M. I. (2002). Testen der Effizienz und Unabhängigkeit von Aufmerksamkeitsnetzwerken. J. Cogn. Neurosci. 14, 340-347. doi: 10.1162/089892902317361886
PubMed Abstract | CrossRef Full Text | Google Scholar
Giesbrecht, B., Weissman, D. H., Woldorff, M. G., and Mangun, G. R. (2006). Pre-Target-Aktivität im visuellen Kortex sagt Verhaltensleistung bei räumlichen und Merkmals-Aufmerksamkeitsaufgaben voraus. Brain Res. 1080, 63-72. doi: 10.1016/j.brainres.2005.09.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Hackley, S. A. (2009). Die Beschleunigung der freiwilligen Reaktion durch ein Warnsignal. Psychophysiology 46, 225-233. doi: 10.1111/j.1469-8986.2008.00716.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Härmä, M., Partinen, M., Repo, R., Sorsa, M., and Siivonen, P. (2008). Auswirkungen von 6/6 und 4/8 Wachsystemen auf die Schläfrigkeit von Brückenoffizieren. Chronobiol. Int. 25, 413-423. doi: 10.1080/07420520802106769
PubMed Abstract | CrossRef Full Text | Google Scholar
Hedden, T., Van Dijk, K. R., Shire, E. H., Sperling, R. A., Johnson, K. A., and Buckner, R. L. (2012). Versagen der Modulation der Aufmerksamkeitskontrolle bei fortgeschrittenem Altern in Verbindung mit Pathologie der weißen Substanz. Cereb. Cortex 22, 1038-1051. doi: 10.1093/cercor/bhr172
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., Ramsey, N. F., de Zwart, J. A., van Gelderen, P., and Duyn, J. H. (2007). fMRI study of effort and information processing in a working memory task. Hum. Brain Mapp. 27, 431-440. doi: 10.1002/hbm.20297
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., and Rutten, G. J. (2017). „A proposal for a system that facilitates quantitative replication of fMRI studies,“ in Proceedings of the Human Brain Mapping Conference 2017 June 25-29, Vancouver, Canada. Online verfügbar unter: https://archive.aievolution.com/2017/hbm1701/index.cfm?do=abs.viewAbs&abs=4047.
Google Scholar
Kriegeskorte, N., Simmons, W. K., Bellgowan, P. S., and Baker, C. I. (2009). Zirkuläre Analyse in der Systemneurowissenschaft: die Gefahren des Double Dipping. Nat. Neurosci. 12, 535-540. doi: 10.1038/nn.2303
PubMed Abstract | CrossRef Full Text | Google Scholar
Kusnir, F., Chica, A. B., Mitsumasu, M. A., and Bartolomeo, P. (2011). Phasic auditory alerting improves visual conscious perception. Conscious. Cogn. 20, 1201-1210. doi: 10.1016/j.concog.2011.01.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Lawrence, M. A., Ross, T. J., Hoffmann, H. G., and Stein, E. S. (2003). Mehrere neuronale Netzwerke vermitteln anhaltende Aufmerksamkeit. J. Cogn. Neurosci. 15, 1028-1038. doi: 10.1162/089892903770007416
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, G., Sobering, G., Duyn, J., and Moonen, C. T. (1993). Eine funktionelle MRT-Technik, die die Prinzipien der Echo-Verschiebung mit einer Reihe von Beobachtungen kombiniert (PRESTO). Magn. Reson. Med. 30, 764-768. doi: 10.1002/mrm.1910300617
PubMed Abstract | CrossRef Full Text | Google Scholar
Macleod, J. W., Lawrence, M. A., McConnell, M. M., Eskes, G. A., Klein, R. M., and Shore, D. I. (2010). Appraising the ANT: Psychometrische und theoretische Überlegungen zum Aufmerksamkeitsnetztest. Neuropsychology 24, 637-651. doi: 10.1037/a0019803
PubMed Abstract |Ref Full Text | Google Scholar
McKiernan, K. A., D’Angelo, B. R. D., Kaufman, J. N., and Binder, J. R. (2006). Die Unterbrechung des „Bewusstseinsstroms“: eine fMRI-Untersuchung. Neuroimage 29, 1185-1191. doi: 10.1016/j.neuroimage.2005.09.030
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., Kaufman, J. N., Kucera-Thompson, J. K., and Binder, J. R. (2003). Eine parametrische Manipulation von Faktoren, die die aufgabeninduzierte Deaktivierung im funktionellen Neuroimaging beeinflussen. J. Cogn. Neurosci. 15, 394-408. doi: 10.1162/089892903321593117
PubMed Abstract | CrossRef Full Text | Google Scholar
Nebes, R. D., and Brady, C. B. (1993). Phasische und tonische Wachheit bei der Alzheimer-Krankheit. Cortex 29, 77-90. doi: 10.1016/s0010-9452(13)80213-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Neggers, S. F., Hermans, E. J., and Ramsey, N. F. (2008). Verbesserte Empfindlichkeit mit schneller dreidimensionaler, vom Blutsauerstoffgehalt abhängiger funktioneller MRT: Vergleich von SENSE-PRESTO und 2D-EPI bei 3 T. NMR Biomed. 21, 663-676. doi: 10.1002/nbm.1235
PubMed Abstract | CrossRef Full Text | Google Scholar
Périn, B., Godefroy, O., Fall, S., and de Marco, G. (2010). Alertness in young healthy subjects: an fMRI study of brain region interactivity enhanced by a warning signal. Brain Cogn. 72, 271-281. doi: 10.1016/j.bandc.2009.09.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pyka, M., Beckmann, C. F., Schöning, S., Hauke, S., Heider, D., Kugel, H., et al. (2009). Auswirkungen der Arbeitsgedächtnisbelastung auf das FMRI-Ruhezustandsmuster in nachfolgenden Ruhephasen. PLoS One 4:e7198. doi: 10.1371/journal.pone.0007198
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E. (2015). The brain’s default mode network. Annu. Rev. Neurosci. 38, 433-447. doi: 10.1146/annurev-neuro-071013-014030
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E., MacLeod, J. W., Snyder, A. Z., Powers, W. J., Gusnard, D. A., and Shulman, G. L. (2001). Ein Standardmodus der Gehirnfunktion. Proc. Natl. Acad. Sci. U S A 98, 676-682. doi: 10.1073/pnas.98.2.676
PubMed Abstract | CrossRef Full Text | Google Scholar
Shulman, G. L., Ollinger, J. M., Akbudak, E., Conturo, T. E., Snyder, A. Z., Petersen, S. E., et al. (1999). Areale, die an der Kodierung und Anwendung von Richtungserwartungen an sich bewegende Objekte beteiligt sind. J. Neurosci. 19, 9480-9496. doi: 10.1523/jneurosci.19-21-09480.1999
PubMed Abstract | CrossRef Full Text | Google Scholar
Singh, K. D., und Fawcett, I. P. (2008). Vorübergehende und linear abgestufte Deaktivierung des menschlichen Default-Mode-Netzwerks durch eine visuelle Erkennungsaufgabe. Neuroimage 41, 100-112. doi: 10.1016/j.neuroimage.2008.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, A. T., Singh, K. D., and Greenlee, M. W. (2000). Aufmerksamkeitsunterdrückung der Aktivität im menschlichen visuellen Kortex. Neuroreport 11, 271-277. doi: 10.1097/00001756-200002070-00010
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., de Simone, A., Krause, B. J., Specht, K., Hessemann, V., Radermacher, I., et al. (1999). Funktionelle Anatomie der intrinsischen Wachheit: Hinweise auf ein froto-parietal-thalamisch-hirnstämmiges Netzwerk in der rechten Hemisphäre. Neuropsychologia 37, 797-805. doi: 10.1016/s0028-3932(98)00141-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., and Willmes, K. (2001). Zur funktionellen Neuroanatomie der intrinsischen und phasischen Wachheit. Neuroimage 14, S76-S84. doi: 10.1006/nimg.2001.0839
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, C. M., Zilles, K., and Fink, G. R. (2004). Zerebrale Korrelate von Aufmerksamkeit, Orientierung und Neuorientierung der visuell-räumlichen Aufmerksamkeit: eine ereigniskorrelierte fMRI-Studie. Neuroimage 21, 318-328. doi: 10.1016/j.neuroimage.2003.08.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automatisierte anatomische Markierung von Aktivierungen in SPM unter Verwendung einer makroskopischen anatomischen Parzellierung des MNI-MRI-Gehirns bei einer einzelnen Person. Neuroimage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
van Gelderen, P., Ramsey, N. F., Liu, G., Duyn, J. H., Frank, J. A., Weinberger, D. R., et al. (1995). Dreidimensionale funktionelle Magnetresonanztomographie des menschlichen Gehirns auf einem klinischen 1,5-T-Scanner. Proc. Natl. Acad. Sci. U S A 92, 6906-6910. doi: 10.1073/pnas.92.15.6906
PubMed Abstract | CrossRef Full Text | Google Scholar
Weinbach, N., and Henik, A. (2011). Phasische Wachsamkeit kann die exekutive Kontrolle modulieren, indem sie die globale Verarbeitung visueller Reize verbessert. Cognition 121, 454-458. doi: 10.1016/j.cognition.2011.08.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Weissman, D. H., Roberts, K. C., Visscher, K. M., and Woldorff, M. G. (2006). Die neuronalen Grundlagen kurzzeitiger Aufmerksamkeitsaussetzer. Nat. Neurosci. 9, 971-978. doi: 10.1038/nn1727
PubMed Abstract | CrossRef Full Text | Google Scholar
Wong, S. W., Massé, N., Kimmerly, D. S., Menon, R. S., and Shoemaker, J. K. (2007). Ventraler medialer präfrontaler Kortex und kardiovagale Kontrolle beim bewussten Menschen. Neuroimage 35, 698-708. doi: 10.1016/j.neuroimage.2006.12.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanaka, H. T., Saito, D. N., Uchiyama, Y., and Sadato, N. (2010). Neuronale Substrate der phasischen Wachsamkeit: eine Studie mit funktioneller Magnetresonanztomographie. Neurosci. Res. 68, 51-58. doi: 10.1016/j.neures.2010.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar