Introduction
Previous research shows that people can use a cue to mentally prepare for a cognitive challenge. Jeśli uczestnicy są poinstruowani, aby mentalnie przygotować się w momencie, gdy wskazówka jest prezentowana, zostało to zdefiniowane jako czujność fazowa. Zdolność do wpływania na nasz poziom czujności może być ważna, szczególnie jeśli czujność wiąże się z kosztami. Jeśli zapotrzebowanie na czujność jest zbyt wysokie, może to potencjalnie prowadzić do zmęczenia (Härmä i in., 2008) lub problemów związanych ze stresem. W tym badaniu chcemy sprawdzić, czy i jak zdrowi dorośli dostrajają swój poziom czujności do oczekiwanej trudności nadchodzącego zadania poznawczego.
Jeśli wskazówka jest prezentowana tuż przed bodźcem do zadania, ludzie są generalnie w stanie reagować szybciej w prostych zadaniach motorycznych (Fan i in., 2002; Macleod i in., 2010; Weinbach i Henik, 2011) i postrzegać zdegradowane bodźce wizualne dokładniej (Kusnir i in., 2011). Badania obrazowe wykazały, że fazowa czujność wiąże się ze zwiększoną aktywacją w czołowych, ciemieniowych, wzgórzowych (Shulman i in., 1999; Fan i in., 2005; Yanaka i in., 2010), skroniowo-potylicznych (Thiel i in., 2004) i wzrokowych obszarach mózgu (Bartolucci i Smith, 2011). Te badania obrazowe dostarczyły cennych informacji na temat reprezentacji czujności fazowej w mózgu. Jednakże, czujność fazowa była zazwyczaj badana jako zjawisko typu włącz/wyłącz lub analiza była ograniczona do kory wzrokowej. Dlatego nie jest jasne, czy czujność odzwierciedla również oczekiwaną trudność wyzwania poznawczego w całych sieciach mózgowych.
Więcej, poprzednie badania wskazały, że dezaktywacja regionów mózgu, które są częścią sieci trybu domyślnego (DMN) może ułatwić wykonanie zadania poznawczego. Po pierwsze, badania nad wykonywaniem zadań pokazują, że rosnący poziom trudności zadania wiąże się z rosnącą dezaktywacją (McKiernan i in., 2003, 2006; Jansma i in., 2007; Singh i Fawcett, 2008; Pyka i in., 2009; Hedden i in., 2012; Čeko i in., 2015). Po drugie, Jansma i wsp. (2007) wykazali, że przyśrodkowa przedczołowa część DMN dostraja się tylko do trudności zadania, którą uczestnik mógł przewidzieć, ale nie miała na nią wpływu rzeczywista trudność każdego bodźca, której uczestnik nie mógł przewidzieć. Wreszcie, Weissman i in. (2006) stwierdzili, że dezaktywacja w DMN tuż przed bodźcem była słabsza, jeśli badani reagowali stosunkowo wolno. Być może te podmioty reagowały wolniej, ponieważ były chwilowo mniej czujne.
Do naszego badania zaprojektowaliśmy zadanie percepcji wzrokowej z warunku łatwego i trudnego. Wskazówki dostarczały informacji o trudności nadchodzącego bodźca, ale nie dostarczały żadnych informacji, które ułatwiałyby samo zadanie. W połowie prób, po wskazówce nie następował bodziec. Tylko te próby były analizowane pod kątem aktywności mózgu, abyśmy mogli całkowicie oddzielić aktywację związaną z podpowiedzią od aktywacji związanej z wykonaniem zadania. Postawiliśmy hipotezę, że uczestnicy dostrajają swoją aktywność do oczekiwanej trudności zadania.
Materiały i Metody
Uczestnicy
Uczestnicy byli rekrutowani poprzez ogłoszenia internetowe. Uczestnicy zostali wykluczeni, jeśli zgłosili w wywiadzie istotne zaburzenia neurologiczne lub psychiatryczne lub przeciwwskazania do badania rezonansem magnetycznym (MRI) (metalowe przedmioty w ciele lub wokół ciała, klaustrofobia lub ciąża). Badanie przeprowadzono zgodnie z zaleceniami Ustawy o badaniach medycznych z udziałem ludzi (WMO), Komisji Etyki Badań Medycznych Brabant. Protokół został zatwierdzony przez Komitet Etyki Badań Medycznych (numer protokołu: NL51147.028.14). Wszyscy badani wyrazili pisemną świadomą zgodę zgodnie z Deklaracją Helsińską.
W badaniu wzięło udział 22 zdrowych praworęcznych ochotników. Dane od dwóch uczestników zostały wykluczone z powodu artefaktów skanera. Wyniki podano dla pozostałych 20 uczestników.
Projekt zadania
Zaprojektowaliśmy zadanie (z konstrukcją związaną ze zdarzeniem), które pozwoliło nam zbadać efekty antycypacji związane z oczekiwaną trudnością zadania, bez zakłócających efektów wykonania zadania.
Bodźce do zadania składały się z dziewięciu strzałek w układzie trzy na trzy na czarnym ekranie (Rysunek 1). Bodziec „łatwy” zawierał osiem strzałek w prawidłowym kierunku i jedną strzałkę w kierunku przeciwnym. Bodziec trudny” zawierał pięć strzałek w prawidłowym kierunku i cztery strzałki w kierunku przeciwnym (Rysunek 1). Uczestnicy byli instruowani, aby nacisnąć przycisk ręką odpowiadającą kierunkowi większości strzałek. Bodźce łatwe i trudne były prezentowane w losowej kolejności. Bodźce podstawowe składały się z nieruchomego czarnego ekranu z tekstem: „masz 30 s przerwy” w języku niderlandzkim i białymi literami. Bodźce były prezentowane przez oprogramowanie „presentation”.
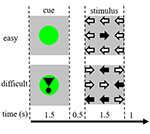
Rysunek 1. Reprezentacja bodźców wzrokowych. Każda próba trwała 4,5 s. W połowie prób po wskazówce nie następował bodziec. Próby te zostały wykorzystane do analizy funkcjonalnego rezonansu magnetycznego (fMRI).
Każda próba rozpoczynała się od wskazówki wskazującej na trudność prezentowanego następnie bodźca. Zielona kropka oznaczała „bodziec łatwy”, zielona kropka z wykrzyknikiem – „bodziec trudny” (ryc. 1).
W połowie prób po wskazówce nie następował bodziec, w drugiej połowie bodziec był prezentowany 500 ms po zniknięciu wskazówki. W ten sposób uzyskano cztery warunki: (1) wskazówka dla bodźca łatwego, po której nie następował bodziec („CueE”); (2) wskazówka dla bodźca trudnego, po której nie następował bodziec („CueD”); (3) wskazówka dla bodźca łatwego, po której następował bodziec łatwy („StimE”); oraz (4) wskazówka dla bodźca trudnego, po której następował bodziec trudny („StimD”). Wszystkie warunki były skontrastowane z poziomem podstawowym. Wyniki funkcjonalnego MRI (fMRI) były oparte na CueE i CueD. Wyniki wydajności oparto na StimE i StimD. CueE i CueD były prezentowane w pseudolosowej kolejności przy użyciu sekwencji M w celu maksymalizacji ogólnej liniowej niezależności regresorów modelu (GLM) pomiędzy warunkami i optymalizacji wydajności projektu (Buracas i Boynton, 2002). Uczestnicy nie mogli przewidzieć, czy po danej wskazówce nastąpi bodziec, czy nie.
Czas trwania każdej próby wynosił 4500 ms. Wskazówki prezentowano przy t = 0 przez 1500 ms, a bodźce przy t = 2000, również przez 1500 ms (ryc. 1). Zadanie wykonywano w dwóch seriach po 68 prób. Linia podstawowa składała się z trzech 30-sekundowych okresów odpoczynku, przed, po i pomiędzy dwoma seriami. Całkowity czas trwania zadania wynosił 11,7 min. Było to drugie zadanie sesji i rozpoczynało się po tym, jak uczestnicy leżeli około 10 min w skanerze.
Uczestników poinstruowano, aby przygotowali się na bodziec łatwy lub trudny na podstawie informacji zawartych w podpowiedzi (ryc. 1) oraz aby wskazali jak najdokładniej i najszybciej kierunek większości strzałek w bodźcu. Uczestnicy ćwiczyli zadanie poza skanerem według standardowego protokołu treningowego trwającego 3 minuty. Protokół ten powtarzano, jeśli wyniki były niewystarczające (poniżej 70% dokładności dla trudnych bodźców).
Lustro przymocowane do cewki głowicy umożliwiło uczestnikom zobaczenie przezroczystego ekranu projekcyjnego umieszczonego za głową. Projektor wideo znajdujący się w pomieszczeniu skanera wyświetlał na ekranie bodźce do wykonania zadania. Do rejestracji odpowiedzi używano dwóch pneumatycznych skrzynek przyciskowych z ciśnieniem powietrza. Uczestnicy używali lewego kciuka lub palca wskazującego do odpowiedzi „w lewo” i prawego do odpowiedzi „w prawo.”
Akwizycja obrazów
Skanowanie wykonano na skanerze 3T Philips Achieva (Philips Medical Systems, Best, Holandia) przy użyciu 32-kanałowej cewki głowicy SENSE. Obraz strukturalny 3D T1-weighted został uzyskany dla celów rejestracji anatomicznej. Obrazy fMRI uzyskano przy użyciu sekwencji impulsów 3D PRESTO. Uzyskano sześć skanów pozornych, które następnie zostały odrzucone przez skaner.
Przetwarzanie obrazu
Dane fMRI zostały wstępnie przetworzone przy użyciu statystycznego mapowania parametrycznego (SPM12; Wellcome Trust Centre for Neuroimaging, University College London, Londyn, Wielka Brytania2). Skany z jednej sesji zostały wyrównane do pierwszego skanu, aby skorygować ruch uczestnika za pomocą metody najmniejszych kwadratów, sześcioparametrowej transformacji przestrzennej (ciała sztywnego) i estymacji B-spline drugiego stopnia. Skany były współrejestrowane do T1 przy użyciu modelu ciała sztywnego. Parametry zostały oszacowane za pomocą znormalizowanej funkcji informacji wzajemnej. Obrazy poddano resekcjonowaniu za pomocą B-splastyki 4 stopnia. T1 zostało znormalizowane przestrzennie do standardowej przestrzeni MNI przy użyciu bardzo lekkiej regularności (0.0001) i B-splastyki 4 stopnia. Uzyskane w ten sposób parametry zastosowano do wszystkich skanów funkcjonalnych w celu zminimalizowania różnic anatomicznych, co umożliwiło analizę grupową. Wreszcie, wszystkie skany zostały przestrzennie wygładzone za pomocą trójwymiarowego filtra gaussowskiego (pełna szerokość przy połowie maksimum: 8 mm), aby jeszcze bardziej zminimalizować efekt funkcjonalnych różnic anatomicznych.
Indywidualna analiza fMRI
Analiza regresji GLM została wykonana dla każdego woksela w celu wygenerowania indywidualnych map aktywacji przy użyciu podejścia masowo-uniwariacyjnego z globalnym przybliżonym modelem autokorelacji AR(1) i filtrem górnoprzepustowym (odcięcie 128 s). Linia podstawowa nie była jawnie modelowana. Podstawową funkcją była kanoniczna HRF bez pochodnych. Zastosowano próg maskowania 0,8. Oddzielne regresory były używane dla każdego warunku (CueE, 17 punktów czasowych; CueD, 16 punktów czasowych; StimE, 17 punktów czasowych; StimD, 18 punktów czasowych; i uciążliwy regresor dla okresów blanc w zadaniu związanym z sekwencją m, 68 punktów czasowych). Żadne punkty czasowe nie zostały wyłączone z analizy. Mapy beta zostały przekształcone tak, by odzwierciedlały rzeczywistą procentową zmianę sygnału w każdym wokselu. Przedstawiamy tylko wyniki dla regresorów CueE i CueD, odzwierciedlające zmiany sygnału dla wskazówek bez bodźca. Beta i statystyczne t-mapy zostały sprawdzone wizualnie dla głównych artefaktów.
Grupowa analiza fMRI
Analiza fMRI drugiego poziomu została wykonana z regresją liniową na każdym wokselu dla wizualizacji i wyboru regionu zainteresowania (ROI). Analiza ROI została przeprowadzona przy użyciu języka danych GNU (GDL3), z wykorzystaniem indywidualnych map procentowych zmian sygnału wygenerowanych przez analizę GLM. Woksele w obrębie ROI lub sieci zostały uśrednione w celu obliczenia różnicy sygnału między CueE, CueD i linią podstawową.
Wybór ROI
Supratentorialne lokalne maksima i minima zostały określone zarówno dla CueE, jak i CueD przez SPM z nieskorygowanym progiem (p < 0,001; Tabela 1). Sześcienne ROI o predefiniowanej wielkości i kształcie umieszczono nad lokalnymi maksimami dla kontrastu CueE-baseline i CueD-baseline oddzielnie w ramach predefiniowanego rastra (Jansma i Rutten, 2017; Tabela 2). ROI zostały włączone do analizy, jeśli zawierały istotne lokalne maksimum dla CueE lub CueD. Definiując ROI na lokalnych maksimach dla obu warunków oddzielnie, zapobiegamy stronniczości w kierunku albo CueE, albo CueD. Ponadto, predefiniowany kształt i rozmiar ROI w rastrze zmniejsza efekt kolistości, ponieważ na granice tych ROI nie ma wpływu szum (Kriegeskorte i in., 2009). Ponadto, metoda ta ułatwia ilościowe porównanie wyników pomiędzy warunkami, a potencjalnie pomiędzy różnymi badaniami, ułatwiając w ten sposób ilościową odtwarzalność wyników fMRI. Umieszczenie ROI nad lokalnymi maksimami optymalizowało moc. Wiadomo jednak, że na lokalizację szczytu aktywności wpływa szum, dlatego dokładna lokalizacja ROI może być zawsze powtarzalna dla każdego ROI. Nie ma to wpływu na wyniki sieci, ponieważ wszystkie ROI są uśrednione, a dokładna lokalizacja nie jest tak istotna.
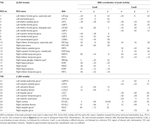
Tabela 1. Wzorzec aktywności.
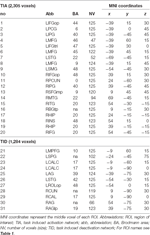
Tabela 2. Charakterystyka regionów zainteresowania (ROI).
ROI nad regionami o zwiększonej zmianie sygnału zostały połączone w sieć aktywacji wywołanej zadaniem („TIA”). ROI nad regionami o zmniejszonej zmianie sygnału połączono w sieć dezaktywacji indukowanej zadaniem („TID”; Tabele 1, 2). Tam, gdzie było to możliwe, nazwy ROI zostały określone przy użyciu atlasu AAL (Tzourio-Mazoyer i in., 2002).
Tabela 2 i Rycina 2 przedstawiają przegląd wielkości i lokalizacji wszystkich ROI. Ponieważ rozmiar i granice ROI są predefiniowane, możliwe jest, że średnia aktywność w ROI nie różni się istotnie od linii podstawowej, na przykład dlatego, że liczba aktywowanych wokseli w obrębie ROI jest stosunkowo niewielka. Chociaż średnia aktywność na poziomie sieci jest znacząco różna od linii podstawowej dla wszystkich warunków (Tabela 3), nie jest tak w przypadku ośmiu z 31 pojedynczych ROI dla CueE i trzech z 31 ROI dla CueD (Tabela 4). Do analizy włączono tylko te woksele, które zawierały sygnał dla każdego uczestnika. Maksymalny rozmiar ROI to 125 wokseli, niektóre ROI zawierają mniej niż 125 wokseli, ponieważ są umieszczone w pobliżu czaszki.
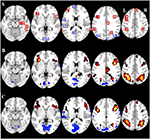
Rysunek 2. Przegląd lokalizacji regionów zainteresowania (ROI) i wyników fMRI całego mózgu. (A) ROI dla aktywacji indukowanej zadaniem (czerwony) i dezaktywacji indukowanej zadaniem (niebieski) Uwaga: ROI 22 nie jest wyświetlany, ponieważ jego lokalizacja znajduje się poza wybranymi plasterkami. Współrzędne MNI, numer BA i rozmiar ROI można znaleźć w Tabeli 2. (B) Wizualna reprezentacja wartości t dla CueE vs. linia podstawowa (≥3 = czerwony do żółtego, ≤ -3 = niebieski do jasnoniebieskiego), (C) Wartości T dla CueD vs. linia podstawowa (≥3 = czerwony do żółtego, ≤ -3 = niebieski do jasnoniebieskiego). Obrazy są w orientacji neurologicznej (L = lewy, R = prawy), nazwy, skróty, współrzędne MNI wokseli szczytowych aktywacji można znaleźć w Tabeli 1.

Tabela 3. Wyniki sieci.
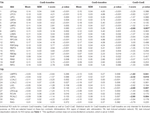
Tabela 4. Wyniki ROI.
Testowanie hipotez
W tym badaniu testowaliśmy następujące hipotezy:
Hipoteza 1: TIA wykaże zwiększoną zmianę sygnału dla CueD, w porównaniu do CueE.
Hipoteza 2: TID wykaże zmniejszoną zmianę sygnału dla CueD, w porównaniu do CueE.
Analiza statystyczna
Analiza mocy nie została przeprowadzona, ponieważ ten specyficzny projekt zadania został przedstawiony uczestnikom po raz pierwszy. Dlatego nie ma wiedzy na temat oczekiwanej procentowej zmiany sygnału i zmienności warunków (Desmond i Glover, 2002).
Dokładność zadania została obliczona dla StimE i StimD jako procent poprawnych odpowiedzi. Czasy reakcji zostały obliczone dla StimE i StimD dla wszystkich poprawnych odpowiedzi.
Jednopróbkowe testy t zostały użyte do porównania procentowej zmiany sygnału dla TIA i TID w porównaniu do linii podstawowej dla CueE i CueD. Jednostronne testy t dla sparowanej próby zostały użyte do porównania zmiany sygnału, dokładności i różnic czasu reakcji pomiędzy CueD i CueE (Hipoteza 1 i 2).
Testy post hoc obejmowały oddzielne testy t dla każdego ROI w obrębie każdej sieci. Analiza ROI była korygowana Bonferroniego, jeśli test omnibus sieci nie był znaczący. Przedstawiamy nieskorygowane wartości p i komentarz stwierdzający, czy ta wartość p przetrwałaby korektę Bonferroniego dla wszystkich wielokrotnych porównań. SPSS 24 został użyty do wszystkich analiz statystycznych.
Wyniki
Wyniki
Dokładność dla łatwych bodźców („StimE”) wynosiła 98% ± 1,2% SEM, a dla trudnych bodźców („StimD”) 85% ± 2,6%. Czas reakcji dla StimE wynosił 682 ± 20 ms, a dla StimD 1,138 ± 27 ms. Oba warunki wykazują wystarczający poziom dokładności, aby mieć pewność, że zadanie zostało wykonane zgodnie z instrukcjami przez wszystkich uczestników. Zgodnie z hipotezą, uczestnicy odpowiadali mniej dokładnie (T = -4,3, p < 0,001) i wolniej (T = 17,8, p < 0,001) dla StimD niż dla StimE (Rysunek 3), wskazując, że kontrast między bodźcami łatwymi i trudnymi był skuteczny.
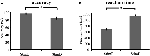
Rysunek 3. Wyniki wydajności. (A) Dokładność dla obu kategorii bodźców, (B) czas reakcji dla obu kategorii bodźców. Słupki błędów przedstawiają błąd standardowy średniej (SEM). *p ≤ 0.001. Skróty: StimE, wskazówka wskazująca na bodziec łatwy, po której następuje bodziec łatwy; StimD, wskazówka wskazująca na bodziec trudny, po której następuje bodziec trudny.
Funkcjonalny MRI
Opisy
Sieć TIA składała się z 20 ROI, z których 10 było opartych na lokalnych maksimach dla CueE, pięć było opartych na lokalnych maksimach dla CueD, a pięć zawierało zarówno maksimum CueE, jak i maksimum CueD (Tabela 1). Z tych 20 ROI, 19 wykazywało znaczącą aktywność w porównaniu do linii podstawowej dla CueE, 18 dla CueD (Tabela 1). Średnia zmiana sygnału w TIA w porównaniu do linii podstawowej dla CueE wynosiła 0,12 ± 0,02 (t = 6,11, p < 0,001), a dla CueD 0,12 ± 0,02 (t = 7,61, p < 0,001).
Sieć TID składała się z 11 ROI, z których trzy opierały się na lokalnych maksimach dla CueE, sześć opierało się na lokalnych maksimach dla CueD, a dwa zawierały zarówno maksimum CueE, jak i CueD (Tabela 1). Z tych 11 ROI, cztery wykazywały znaczącą aktywność w porównaniu do linii podstawowej dla CueE, 10 dla CueD (Tabela 1). Średnia zmiana sygnału w TID w stosunku do linii podstawowej dla CueE wynosiła -0,07 ± 0,02 (t = 2,68, p < 0,01), a dla CueD -0,12 ± 0,02 (t = 5,37, p < 0,001; tab. 3).
Tuning to the Expected Difficulty
Wzrost sygnału w TIA nie był istotnie silniejszy dla CueD w porównaniu z CueE (t = -0,24, p = 0,41) wskazując, że poziom aktywacji TIA nie jest dostrojony do oczekiwanej trudności (Rycina 4, Tabela 3). Analiza post hoc ROI nie wykazała żadnego z 20 ROI w obrębie TIA z istotnym wzrostem sygnału dla CueD w porównaniu z CueE po zastosowaniu korekty Bonferroniego (Tabela 4, Rysunek 5).
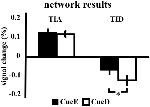
Rysunek 4. Przegląd wyników badań sieciowych. Słupki błędów przedstawiają SEM. *p ≤ 0,05 dla cue difficult vs. cue easy. Skróty: TIA, sieć aktywacji indukowanej zadaniem; TID, sieć dezaktywacji indukowanej zadaniem; CueE, wskazówka wskazująca na bodziec łatwy, po której nie następuje bodziec; CueD, wskazówka wskazująca na bodziec trudny, po której nie następuje bodziec.
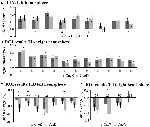
Rysunek 5. Przegląd indywidualnych odpowiedzi ROI w obrębie sieci aktywacji indukowanej zadaniem, lewa (A) i prawa półkula (B), oraz dezaktywacji indukowanej zadaniem, lewa (C), i prawa półkula (D). Słupki błędów przedstawiają SEM. *p ≤ 0,05 dla CueD vs. CueE, patrz Rycina 2 dla lokalizacji ROI, patrz Tabela 1 dla nazw, skrótów i współrzędnych MNI ROI.
Zmniejszenie sygnału w TID było znacząco silniejsze dla CueD w porównaniu z CueE (T = -2,48, p = 0,01) wskazując, że poziom TID jest dostrojony do oczekiwanej trudności (Tabela 3, Rycina 4). Analiza post hoc ROI wykazała cztery z 11 ROI TID z istotnym spadkiem sygnału dla CueD w porównaniu z CueE, a mianowicie LMPFG (T = -1,83, p = 0,04), LSPG (T = -2,32, p = 0,02), LSTG (T = -2,69, p < 0,01) i RCALC (T = -2,90, p < 0,01). Wyniki te wskazują, że dostrojenie do oczekiwanej trudności jest najsilniejsze w lewych czołowych, skroniowych i wzrokowych ROI (Tabela 4, Rysunek 5).
Dyskusja
W tym badaniu sprawdziliśmy, czy i jak czujność fazowa jest dostrojona do oczekiwanej trudności nadchodzącego wyzwania poznawczego. Fazowa czujność była odzwierciedlona w aktywowanych, jak również dezaktywowanych regionach mózgu. Aktywowana sieć obejmowała regiony centralnej sieci wykonawczej. Sieć dezaktywowana obejmowała regiony DMN, a także kory wzrokowe. Poziom dezaktywacji skalował się wraz z oczekiwaną trudnością nadchodzącego bodźca, podczas gdy poziom aktywacji nie. Wyniki te sugerują, że modulacja czujności fazowej jest odzwierciedlona głównie w stopniowanych procesach tłumienia, które nie mają znaczenia dla bieżącego zadania (np. procesy kardio-wagalne, słuchowe i wzrokowe). Możliwe, że dzieje się tak dlatego, że procesy te mogłyby kolidować z nadchodzącymi wyzwaniami poznawczymi.
Poprzednie badania obrazowe czujności fazowej wykorzystywały jeden poziom trudności, prezentowały tylko aktywowane regiony mózgu (Shulman i in., 1999; Sturm i Willmes, 2001; Thiel i in., 2004; Fan i in., 2005; Périn i in., 2010; Yanaka i in., 2010) lub skupiały się wyłącznie na aktywności w korze wzrokowej (Bartolucci i Smith, 2011). Badania te pozwoliły na identyfikację głównie prawostronnie zlokalizowanej sieci czołowo-ciemieniowo-wzgórzowej, czasami połączonej z obszarami kory ruchowej i wzrokowej, która była aktywowana przez podpowiedź. Istnieją znaczne różnice w aktywowanych sieciach pomiędzy badaniami. Niektóre z różnic pomiędzy sieciami w poprzednich badaniach mogą być wyjaśnione przez zadanie, które następowało po podpowiedzi. Na przykład Thiel i wsp. (2004) zidentyfikowali aktywację tylko w wizualnych regionach korowych za pomocą zadania percepcji wzrokowej, podczas gdy Fan i wsp. (2005) oraz Yanaka i wsp. (2010) zidentyfikowali aktywację wzgórzową i motoryczną za pomocą zadania odpowiedzi motorycznej. Bartolucci i Smith (2011) przedstawili elegancką konstrukcję zadania z czterema poziomami trudności zadania dyskryminacji orientacji, jednak wykazali aktywację tylko w korze wzrokowej. Nie jest zatem jasne, jak inne regiony mózgu reagowały w tym zadaniu. Sieć aktywacji wywołanej zadaniem, zidentyfikowana w obecnym badaniu jest najbardziej podobna do sieci znalezionej przez Shulmana i wsp. (1999), którzy wykorzystali podobny typ zadania przetwarzania wzrokowego.
Nie jest jasne, czy czujność fazowa jest oddolną czy odgórną odpowiedzią na nieinformacyjną wskazówkę (Thiel i wsp., 2004; Hackley, 2009; Périn i wsp., 2010; Bartolucci i Smith, 2011; Chica i wsp., 2016). Czujność fazowa była uważana przez niektórych za reakcję typu bottom-up (Sturm i in., 1999; Hackley, 2009), przez innych za top-down (Bartolucci i Smith, 2011), a przez jeszcze innych za kombinację (Thiel i in., 2004; Périn i in., 2010). Twierdzimy, że najbardziej odpowiednie jest oznaczenie odpowiedzi mózgu na wskazówkę jako połączenie przetwarzania oddolnego i odgórnego, ponieważ uczestnicy reagują zarówno na zewnętrzną wskazówkę, jak i na instrukcję związaną z tą wskazówką. Nasze główne wyniki dotyczą jednak różnicy w odpowiedzi na dwie podobne wskazówki wskazujące na inny rodzaj bodźca zadaniowego. Dlatego twierdzimy, że wynikająca z tego różnica między wskazówką wskazującą na trudne zadanie a wskazówką wskazującą na łatwe zadanie może reprezentować poziom kontroli odgórnej związanej z interpretacją wskazówki i związanej z nią instrukcji.
Sieć dezaktywacji wywołanej zadaniem obejmowała regiony mózgu należące do DMN, a mianowicie przyśrodkowy zakręt przedczołowy, górne zakręty skroniowe i zakręty kątowe (Shulman i in., 1999; Raichle i in., 2001; Raichle, 2015). Powszechna jest hipoteza, że dezaktywacja DMN wspomaga wykonywanie zadań poprzez redukcję procesów wewnętrznych, które przeszkadzają w realizacji wyzwań poznawczych (Raichle i in., 2001; Buckner i in., 2008; Raichle, 2015). Pogląd ten wspierają badania pokazujące, że poziom dezaktywacji DMN skaluje się wraz z trudnością zadania podczas jego wykonywania (McKiernan i in., 2003; Singh i Fawcett, 2008). Badania te dotyczyły dezaktywacji podczas wykonywania zadania. Nasze wyniki sugerują, że takie skalowanie może występować już w fazie antycypacji zadania. Weissman et al. (2006) badali zmienność indywidualnych czasów reakcji w celu zidentyfikowania lapsusów uwagi. Luki uwagi mogą być związane z obniżoną dezaktywacją DMN. Podczas gdy (Weissman i in., 2006) przyglądali się naturalnej zmienności w poziomie czujności, nasze wyniki wskazują, że dezaktywacja w kilku regionach DMN może być również dostrojona w sposób odgórny przed prezentacją bodźca zadaniowego.
Najgłębsze efekty dostrojenia zostały znalezione w lewym przyśrodkowym przedczołowym, skroniowym i wzrokowym regionie. Poniżej omawiamy możliwe implikacje tych efektów dla tych regionów w odniesieniu do ich proponowanej funkcji.
Aktywność przyśrodkowej kory przedczołowej została wcześniej powiązana z wędrówką umysłu (Bertossi i in., 2017), odzyskiwaniem pamięci (Euston i in., 2012) i kontrolą kardiovagalną (Wong i in., 2007). Ta przyśrodkowa przedczołowa dezaktywacja sugeruje, że którakolwiek z tych funkcji jest już tłumiona w oczekiwaniu na wyzwanie poznawcze.
Strojenie dezaktywacji do oczekiwanej trudności w regionach wzrokowych i skroniowych może być związane z tłumieniem nieistotnych wizualnych i słuchowych danych wejściowych sensorycznych. Dostrojenie w dwustronnych regionach skroniowych może być szczególnie związane z tłumieniem hałasu generowanego przez skaner MRI. Uzasadnione jest oczekiwanie, że poziom dźwięku jest podobny w różnych warunkach. Fakt, że poziom dezaktywacji jest silniejszy dla trudnych wskazówek sugeruje, że przetwarzanie dźwięków otoczenia jest tłumione silniej, jeśli spodziewane jest trudne zadanie. Dezaktywacja w korze wzrokowej jest rzadziej opisywana niż dezaktywacja w okolicach skroniowych. Jednakże Smith i wsp. (2000) stwierdzili związek pomiędzy rozległą dezaktywacją w korze wzrokowej a koncentracją uwagi na określonej części obrazu. Giesbrecht i wsp. (2006) również stwierdzili modulację aktywacji wzrokowej związanej z ukrytą uwagą na obiekty znajdujące się blisko centrum pola widzenia w porównaniu z obiektami znajdującymi się w peryferyjnym polu widzenia. Wyniki te wskazują, że aktywacja w korze wzrokowej może być modulowana przez ukrytą uwagę skierowaną na regiony fovealne lub peryferyjne. Nasze badanie dodaje nowy wymiar do tych ustaleń, ponieważ sugeruje, że aktywacja w korach wzrokowych jest modulowana nie tylko przez lokalizację ukrytej uwagi wzrokowej, ale także przez oczekiwaną trudność wyzwania wizualnego; a ponieważ wskazówki były identyczne pod względem lokalizacji i wielkości, proces ten wydaje się regulowany w sposób odgórny.
Zidentyfikowaliśmy także zestaw regionów mózgu, które wykazywały zwiększoną aktywację w oczekiwaniu na wyzwanie poznawcze. Sieć ta wykazała podobieństwo do centralnej sieci wykonawczej, która wcześniej była związana z wykonywaniem zadań pamięci roboczej (Lawrence i in., 2003). Jednakże, aktywacja w tej sieci nie była dostrojona do oczekiwanej trudności zadania. Sugeruje to, że regiony te reprezentują procesy, które są podobne dla warunku trudnego i łatwego. Możliwe, że aktywność w tej sieci jest związana z oceną wskazówki, lub z odzyskiwaniem i utrzymywaniem kontekstu zadania i instrukcji.
Należy wziąć pod uwagę pewne ograniczenia, które mogą wpłynąć na interpretację naszych wyników. Po pierwsze, nie uwzględniliśmy prób z bodźcami, które nie były poprzedzone wskazówką, dlatego nie jest możliwe zbadanie wpływu wskazówki na wydajność poznawczą. Ze względu na ograniczenia czasowe, nie było możliwe powtórzenie naszego zadania z użyciem identycznych bodźców, ale bez wskazówek.
Po drugie, użyliśmy wykrzyknika jako części wskazówki wskazującej na trudne wyzwanie poznawcze, ponieważ symbol ten jest zwykle używany, gdy istnieje potrzeba zwiększonej czujności. Jest możliwe, że sam wykrzyknik mógł odegrać rolę w różnych wzorcach aktywacji dla łatwego i trudnego warunku, ze względu na jego nieodłączne znaczenie. Nie wpływa to jednak na główną interpretację naszych wyników, z wyjątkiem tego, że nasze główne wyniki mogą być sklasyfikowane jako reakcja typu bottom-up zamiast top-down. Wreszcie, nasz eksperymentalny projekt nie pozwala nam zbadać, czy aktywność związana z czujnością fazową może być uogólniona na inne domeny, lub czy jest specyficzna dla danej domeny, ponieważ obejmowała tylko wizualno-percepcyjne wyzwanie poznawcze.
Podsumowując, w tym badaniu wykazaliśmy, że dostrajanie czujności fazowej jest reprezentowane przez poziom dezaktywacji w kilku regionach. Efekt ten jest najsilniejszy w przyśrodkowej korze przedczołowej, wzrokowej i skroniowej, co może odzwierciedlać tłumienie kontroli kardiovagalnej, przetwarzanie wizualne w peryferyjnym polu widzenia i tłumienie szumu skanera MRI. Wyniki te sugerują, że wydajność poznawcza jest ułatwiona przez stan mózgu, który jest ściśle powiązany z oczekiwaniami dotyczącymi trudności nadchodzącego wyzwania poznawczego.
Dostępność danych
Dane surowe zostały wygenerowane w szpitalu Elisabeth-Tweesteden. Dane pochodne, które potwierdzają wyniki tego badania, są dostępne u autora na uzasadnioną prośbę.
Oświadczenie etyczne
Badanie przeprowadzono zgodnie z zaleceniami holenderskiej ustawy o wsparciu społecznym, medycznej komisji etycznej Brabant. Wszyscy badani wyrazili pisemną świadomą zgodę zgodnie z Deklaracją Helsińską. Protokół został zatwierdzony przez medyczną komisję etyczną Brabant.
Wkład autorów
MD i JJ napisali główny manuskrypt i przygotowali ryciny. MD i IS przeprowadzili eksperymenty. G-JR, NR i JJ wspólnie nadzorowali pracę. Wszyscy autorzy recenzowali manuskrypt.
Funding
Ta praca została sfinansowana przez ZonMW, holenderską organizację narodową (Netherlands Organization for Health Research and Development, ZONMW; numer projektu: 842003004), tytuł projektu: Clinical implementation of advanced MRI techniques for localization and monitoring of sensimotor and cognitive functions in patients with brain tumors.
Oświadczenie o konflikcie interesów
Autorzy deklarują, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych powiązań, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Chcielibyśmy podziękować radiologom Williamowi Pigmansowi i Maikelowi Brandsowi za ich wkład w to badanie.
Skróty
DMN, default mode network; M, mężczyzna; F, kobieta; GLM, ogólny model liniowy; SPM, statystyczne mapowanie parametryczne; CueE, wskazówka wskazująca na bodziec łatwy, po którym nie następuje bodziec; CueD, wskazówka wskazująca na bodziec trudny, po którym nie następuje bodziec; StimE, wskazówka wskazująca na bodziec łatwy, po którym następuje bodziec łatwy; StimD, wskazówka wskazująca na bodziec trudny, po którym następuje bodziec trudny; MRI, obrazowanie rezonansem magnetycznym; ROI, region zainteresowania; GDL, język danych GNU; TIA, sieć aktywacji indukowanej zadaniem; TID, sieć dezaktywacji indukowanej zadaniem; SEM, błąd standardowy średniej.
Footnotes
- ^ https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/project-detail/topzorg/clinical-implementation-of-advanced-mri-techniques-for-localization-and-monitoring-of-sensorimotor-a/verslagen/
- ^ http://www.fil.ion.ucl.ac.uk/spm/software/spm12/
- ^ https://github.com/gnudatalanguage/gdl
Bartolucci, M., and Smith, A. T. (2011). Attentional modulation in visual cortex is modified during perceptual learning. Neuropsychologia 49, 3898-3907. doi: 10.1016/j.neuropsychologia.2011.10.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bertossi, E., Peccenini, L., Solmi, A., Avenanti, A., and Ciaramelli, E. (2017). Transcranial direct current stimulation of the medial prefrontal cortex dampens mind-wandering in men. Sci. Rep. 7:16962. doi: 10.1038/s41598-017-17267-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Buckner, R. L., Andrews-Hanna, J. R., and Schacter, D. L. (2008). The brain’s default network: anatomy, function and relevance to disease. Ann. N Y Acad. Sci. 1124, 1-38. doi: 10.1196/annals.1440.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Buracas, G. T., and Boynton, G. M. (2002). Efficient design of event-related fMRI experiments using M-sequences. Neuroimage 16, 801-813. doi: 10.1006/nimg.2002.1116
PubMed Abstract | CrossRef Full Text | Google Scholar
Čeko, M., Gracely, J. L., Fitzcharles, M. A., Seminowicz, D. A., Schweinhardt, P., and Bushnell, M. C. (2015). Is a responsive default mode network required for successful working memory task performance? J. Neurosci. 35, 11595-11605. doi: 10.1523/JNEUROSCI.0264-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Chica, A. B., Bayle, D. J., Botta, F., Bartolomeo, P., and Paz-Alonso, P. M. (2016). Interakcje pomiędzy phasic alerting i świadomością w sieci fronto-striatalnej. Sci. Rep. 6:13. doi: 10.1038/srep31868
PubMed Abstract | CrossRef Full Text | Google Scholar
Desmond, J. E., and Glover, G. H. (2002). Estimating sample size in functional MRI (fMRI) neuroimaging studies: statistical power analyses. J. Neurosci. Methods 118, 115-128. doi: 10.1016/s0165-0270(02)00121-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Euston, D. R., Gruber, A. J., and McNaughton, B. L. (2012). The role of medial prefrontal cortex in memory and decision making. Neuron 76, 1057-1070. doi: 10.1016/j.neuron.2012.12.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Fossella, J., Flombaum, J. I., and Posner, M. I. (2005). Aktywacja sieci uwagowych. Neuroimage 26, 471-479. doi: 10.1016/j.neuroimage.2005.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Sommer, T., Raz, A., and Posner, M. I. (2002). Testing the efficiency and independence of attentional networks. J. Cogn. Neurosci. 14, 340-347. doi: 10.1162/089892902317361886
PubMed Abstract | CrossRef Full Text | Google Scholar
Giesbrecht, B., Weissman, D. H., Woldorff, M. G., and Mangun, G. R. (2006). Pre-target activity in visual cortex predicts behavioral performance on spatial and feature attention tasks. Brain Res. 1080, 63-72. doi: 10.1016/j.brainres.2005.09.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Hackley, S. A. (2009). Przyspieszenie dobrowolnej reakcji przez sygnał ostrzegawczy. Psychophysiology 46, 225-233. doi: 10.1111/j.1469-8986.2008.00716.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Härmä, M., Partinen, M., Repo, R., Sorsa, M., and Siivonen, P. (2008). Effects of 6/6 and 4/8 watch systems on sleepiness among bridge officers. Chronobiol. Int. 25, 413-423. doi: 10.1080/07420520802106769
PubMed Abstract | CrossRef Full Text | Google Scholar
Hedden, T., Van Dijk, K. R., Shire, E. H., Sperling, R. A., Johnson, K. A., and Buckner, R. L. (2012). Failure to modulate attentional control in advanced aging linked to white matter pathology. Cereb. Cortex 22, 1038-1051. doi: 10.1093/cercor/bhr172
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., Ramsey, N. F., de Zwart, J. A., van Gelderen, P., and Duyn, J. H. (2007). fMRI study of effort and information processing in a working memory task. Hum. Brain Mapp. 27, 431-440. doi: 10.1002/hbm.20297
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., and Rutten, G. J. (2017). „A proposal for a system that facilitates quantitative replication of fMRI studies,” in Proceedings of the Human Brain Mapping Conference 2017 June 25-29, Vancouver, Canada. Dostępne online na: https://archive.aievolution.com/2017/hbm1701/index.cfm?do=abs.viewAbs&abs=4047.
Google Scholar
Kriegeskorte, N., Simmons, W. K., Bellgowan, P. S., and Baker, C. I. (2009). Analiza kołowa w neurobiologii systemowej: niebezpieczeństwa podwójnego zanurzenia. Nat. Neurosci. 12, 535-540. doi: 10.1038/nn.2303
PubMed Abstract | CrossRef Full Text | Google Scholar
Kusnir, F., Chica, A. B., Mitsumasu, M. A., and Bartolomeo, P. (2011). Phasic auditory alerting improves visual conscious perception. Conscious. Cogn. 20, 1201-1210. doi: 10.1016/j.concog.2011.01.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Lawrence, M. A., Ross, T. J., Hoffmann, H. G., and Stein, E. S. (2003). Multiple neural networks mediate sustained attention. J. Cogn. Neurosci. 15, 1028-1038. doi: 10.1162/089892903770007416
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, G., Sobering, G., Duyn, J., and Moonen, C. T. (1993). A functional MRI technique combining principles of echo-shifting with a train of observations (PRESTO). Magn. Reson. Med. 30, 764-768. doi: 10.1002/mrm.1910300617
PubMed Abstract | CrossRef Full Text | Google Scholar
Macleod, J. W., Lawrence, M. A., McConnell, M. M., Eskes, G. A., Klein, R. M., and Shore, D. I. (2010). Appraising the ANT: psychometryczne i teoretyczne rozważania na temat testu sieci uwagi. Neuropsychology 24, 637-651. doi: 10.1037/a0019803
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., D’Angelo, B. R. D., Kaufman, J. N., and Binder, J. R. (2006). Interrupting the „stream of consciousness”: an fMRI investigation. Neuroimage 29, 1185-1191. doi: 10.1016/j.neuroimage.2005.09.030
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., Kaufman, J. N., Kucera-Thompson, J. K., and Binder, J. R. (2003). A parametric manipulation of factors affecting task-induced deactivation in functional neuroimaging. J. Cogn. Neurosci. 15, 394-408. doi: 10.1162/089892903321593117
PubMed Abstract | CrossRef Full Text | Google Scholar
Nebes, R. D., and Brady, C. B. (1993). Phasic and tonic alertness in Alzheimer’s disease. Cortex 29, 77-90. doi: 10.1016/s0010-9452(13)80213-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Neggers, S. F., Hermans, E. J., and Ramsey, N. F. (2008). Enhanced sensitivity with fast three-dimensional blood-oxygen-level-dependent functional MRI: comparison of SENSE-PRESTO and 2D-EPI at 3 T. NMR Biomed. 21, 663-676. doi: 10.1002/nbm.1235
PubMed Abstract | CrossRef Full Text | Google Scholar
Périn, B., Godefroy, O., Fall, S., and de Marco, G. (2010). Alertness in young healthy subjects: an fMRI study of brain region interactivity enhanced by a warning signal. Brain Cogn. 72, 271-281. doi: 10.1016/j.bandc.2009.09.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pyka, M., Beckmann, C. F., Schöning, S., Hauke, S., Heider, D., Kugel, H., et al. (2009). Impact of working memory load on FMRI resting state pattern in subsequent resting phases. PLoS One 4:e7198. doi: 10.1371/journal.pone.0007198
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E. (2015). The brain’s default mode network. Annu. Rev. Neurosci. 38, 433-447. doi: 10.1146/annurev-neuro-071013-014030
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E., MacLeod, J. W., Snyder, A. Z., Powers, W. J., Gusnard, D. A., and Shulman, G. L. (2001). Domyślny tryb funkcjonowania mózgu. Proc. Natl. Acad. Sci. U S A 98, 676-682. doi: 10.1073/pnas.98.2.676
PubMed Abstract | CrossRef Full Text | Google Scholar
Shulman, G. L., Ollinger, J. M., Akbudak, E., Conturo, T. E., Snyder, A. Z., Petersen, S. E., et al. (1999). Areas involved in encoding and applying directional expectations to moving objects. J. Neurosci. 19, 9480-9496. doi: 10.1523/jneurosci.19-21-09480.1999
PubMed Abstract | CrossRef Full Text | Google Scholar
Singh, K. D., and Fawcett, I. P. (2008). Transient and linearly graded deactivation of the human default-mode network by a visual detection task. Neuroimage 41, 100-112. doi: 10.1016/j.neuroimage.2008.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, A. T., Singh, K. D., and Greenlee, M. W. (2000). Attentional suppression of activity in the human visual cortex. Neuroreport 11, 271-277. doi: 10.1097/00001756-200002070-00010
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., de Simone, A., Krause, B. J., Specht, K., Hessemann, V., Radermacher, I., et al. (1999). Functional anatomy of intrinsic alertness: evidence for a froto-parietal-thalamic-brainstem network in the right hemisphere. Neuropsychologia 37, 797-805. doi: 10.1016/s0028-3932(98)00141-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., and Willmes, K. (2001). O funkcjonalnej neuroanatomii wewnętrznej i fazowej czujności. Neuroimage 14, S76-S84. doi: 10.1006/nimg.2001.0839
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, C. M., Zilles, K., and Fink, G. R. (2004). Cerebral correlates of alerting, orienting and reorienting of visuospatial attention: an event-related fMRI study. Neuroimage 21, 318-328. doi: 10.1016/j.neuroimage.2003.08.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. Neuroimage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
van Gelderen, P., Ramsey, N. F., Liu, G., Duyn, J. H., Frank, J. A., Weinberger, D. R., et al. (1995). Three-dimensional functional magnetic resonance imaging of human brain on a clinical 1.5-T scanner. Proc. Natl. Acad. Sci. U S A 92, 6906-6910. doi: 10.1073/pnas.92.15.6906
PubMed Abstract | CrossRef Full Text | Google Scholar
Weinbach, N., and Henik, A. (2011). Phasic alertness can modulate executive control by enhancing global processing of visual stimuli. Cognition 121, 454-458. doi: 10.1016/j.cognition.2011.08.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Weissman, D. H., Roberts, K. C., Visscher, K. M., and Woldorff, M. G. (2006). The neural bases of momentary lapses in attention. Nat. Neurosci. 9, 971-978. doi: 10.1038/nn1727
PubMed Abstract | CrossRef Full Text | Google Scholar
Wong, S. W., Massé, N., Kimmerly, D. S., Menon, R. S., and Shoemaker, J. K. (2007). Ventral medial prefrontal cortex and cardiovagal control in conscious humans. Neuroimage 35, 698-708. doi: 10.1016/j.neuroimage.2006.12.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanaka, H. T., Saito, D. N., Uchiyama, Y., and Sadato, N. (2010). Neural substrates of phasic czujność: funkcjonalnego rezonansu magnetycznego badania. Neurosci. Res. 68, 51-58. doi: 10.1016/j.neures.2010.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
.