Introducción
Investigaciones anteriores muestran que las personas pueden utilizar una pista para prepararse mentalmente para un desafío cognitivo. Si se indica a los participantes que se preparen mentalmente en el momento en que se presenta una pista, esto se ha definido como alerta fásica . La capacidad de influir en nuestro nivel de alerta podría ser importante, especialmente si la alerta tiene un coste. Si la demanda de alerta es demasiado alta, podría provocar fatiga (Härmä et al., 2008) o problemas relacionados con el estrés. En este estudio, pretendemos examinar si los adultos sanos sintonizan su nivel de alerta con la dificultad esperada de una tarea cognitiva próxima y cómo lo hacen.
Si se presenta una señal justo antes del estímulo de una tarea, las personas suelen ser capaces de responder más rápido en tareas de respuesta motora simple (Fan et al., 2002; Macleod et al., 2010; Weinbach y Henik, 2011) y perciben con mayor precisión los estímulos visuales degradados (Kusnir et al., 2011). Los estudios de imagen han demostrado que el estado de alerta fásico se asocia con una mayor activación en regiones cerebrales frontales, parietales, talámicas (Shulman et al., 1999; Fan et al., 2005; Yanaka et al., 2010), temporo-occipitales (Thiel et al., 2004) y visuales (Bartolucci y Smith, 2011). Estos estudios de imagen han proporcionado información valiosa sobre la representación del estado de alerta fásico en el cerebro. Sin embargo, el estado de alerta fásico se ha estudiado generalmente como un fenómeno de encendido/apagado o el análisis se ha restringido a la corteza visual. Por lo tanto, no está claro si el estado de alerta también refleja la dificultad esperada del desafío cognitivo en las redes cerebrales completas.
Además, estudios anteriores han indicado que la desactivación de las regiones cerebrales que forman parte de la red de modo por defecto (DMN) puede facilitar la ejecución de tareas cognitivas. En primer lugar, los estudios sobre la ejecución de tareas muestran que un nivel creciente de dificultad de la tarea se asocia con una mayor desactivación (McKiernan et al., 2003, 2006; Jansma et al., 2007; Singh y Fawcett, 2008; Pyka et al., 2009; Hedden et al., 2012; Čeko et al., 2015). En segundo lugar, Jansma et al. (2007) han demostrado que la parte prefrontal medial de la DMN solo sintoniza con la dificultad de la tarea, que el participante podía anticipar, pero no se veía afectada por la dificultad real de cada estímulo, que el participante no podía anticipar. Finalmente, Weissman et al. (2006) encontraron que la desactivación en la DMN justo antes del estímulo era más débil si los sujetos respondían de forma relativamente lenta. Tal vez estos sujetos respondían más lentamente porque estaban temporalmente menos alerta.
Para nuestro estudio, diseñamos una tarea de percepción visual con pistas con una condición fácil y otra difícil. Las señales proporcionaban información sobre la dificultad del próximo estímulo, pero no proporcionaban ninguna información que facilitara la tarea en sí. En la mitad de los ensayos, la señal no iba seguida de un estímulo. Sólo se analizó la actividad cerebral de estos ensayos para poder aislar completamente la activación asociada a la pista de la activación asociada a la ejecución de la tarea. Nuestra hipótesis es que los participantes ajustan su actividad a la dificultad esperada de la tarea.
Materiales y métodos
Participantes
Los participantes fueron reclutados a través de anuncios en línea. Se excluyeron los participantes que informaron de antecedentes de trastornos neurológicos o psiquiátricos significativos, o de contraindicaciones para la exploración por resonancia magnética (MRI) (objetos metálicos en el cuerpo o a su alrededor, claustrofobia o embarazo). Este estudio se llevó a cabo de acuerdo con las recomendaciones de la Ley de Investigación Médica en Seres Humanos (OMM), Comité de Ética de la Investigación Médica de Brabante. El protocolo fue aprobado por el Comité Ético de Investigación Médica (número de protocolo: NL51147.028.14). Todos los sujetos dieron su consentimiento informado por escrito de acuerdo con la Declaración de Helsinki.
Veintidós voluntarios sanos diestros participaron en el estudio. Se excluyeron los datos de dos participantes debido a artefactos del escáner. Se presentan los resultados de los 20 participantes restantes.
Diseño de la tarea
Diseñamos una tarea (con diseño relacionado con el evento) que nos permitió examinar los efectos de anticipación relacionados con la dificultad esperada de una tarea, sin confundir los efectos de la ejecución de la tarea.
Los estímulos de la tarea consistían en nueve flechas en una disposición de tres por tres en una pantalla negra (Figura 1). Un «estímulo fácil» contenía ocho flechas en la dirección correcta y una flecha en la dirección opuesta. Un «estímulo difícil» contenía cinco flechas en la dirección correcta y cuatro flechas en la dirección opuesta (Figura 1). Los participantes debían pulsar un botón con la mano correspondiente a la dirección de la mayoría de las flechas. Los estímulos fáciles y difíciles se presentaron en un orden aleatorio. Los estímulos de referencia consistían en una pantalla negra fija con el texto «tienes un descanso de 30 s» en holandés y en letras blancas. Los estímulos se presentaron mediante el software «presentation».
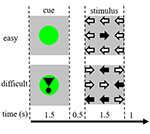
Figura 1. Representación de los estímulos visuales. Cada ensayo tenía una duración de 4,5 s. En la mitad de los ensayos la señal no iba seguida de un estímulo. Estos ensayos se utilizaron para el análisis de imágenes de resonancia magnética funcional (fMRI).
Cada ensayo comenzaba con una señal que indicaba la dificultad del estímulo presentado posteriormente. Un punto verde indicaba un «estímulo fácil», un punto verde con un signo de exclamación indicaba un «estímulo difícil» (Figura 1).
En la mitad de los ensayos, la señal no iba seguida de un estímulo, en la otra mitad el estímulo se presentaba 500 ms después de que desapareciera la señal. Esto dio lugar a cuatro condiciones: (1) una señal para un estímulo fácil, no seguida de un estímulo («CueE»); (2) una señal para un estímulo difícil, no seguida de un estímulo («CueD»); (3) una señal para un estímulo fácil, seguida de un estímulo fácil («StimE»); y (4) una señal para un estímulo difícil, seguida de un estímulo difícil («StimD»). Todas las condiciones se contrastaron con la línea de base. Los resultados de la resonancia magnética funcional (fMRI) se basaron en CueE y CueD. Los resultados de rendimiento se basaron en StimE y StimD. Los CueE y CueD se presentaron en un orden pseudo-aleatorio utilizando secuencias M para maximizar la independencia de los regresores del modelo lineal general (GLM) entre las condiciones y optimizar la eficiencia del diseño (Buracas y Boynton, 2002). Los participantes no podían predecir si una señal sería seguida por un estímulo o no.
La duración de cada ensayo era de 4.500 ms. Las señales se presentaron en t = 0 durante 1.500 ms y los estímulos se presentaron en t = 2.000, también durante 1.500 ms (Figura 1). La tarea se realizó en dos series de 68 ensayos. La línea de base consistió en tres periodos de descanso de 30 s, antes, después y entre las dos ejecuciones. La duración total de la tarea fue de 11,7 minutos. Esta fue la segunda tarea de la sesión y comenzó después de que los participantes estuvieran tumbados aproximadamente 10 min en el escáner.
Se instruyó a los participantes para que se prepararan para un estímulo fácil o difícil basándose en la información de la pista (Figura 1) y para que indicaran con la mayor precisión y rapidez posible la dirección de la mayoría de las flechas del estímulo. Los participantes practicaron la tarea fuera del escáner siguiendo un protocolo de práctica estándar de 3 minutos. Este protocolo se repitió si el rendimiento era insuficiente (por debajo del 70% de precisión para los estímulos difíciles).
Un espejo unido a la bobina de la cabeza permitía a los participantes ver una pantalla de proyección transparente colocada detrás de la cabeza. Un proyector de vídeo dentro de la sala del escáner proyectaba los estímulos de la tarea en la pantalla. Se utilizaron dos cajas de botones neumáticos con presión de aire para registrar las respuestas. Los participantes utilizaron el pulgar o el dedo índice izquierdo para responder «izquierda» y el derecho para responder «derecha».
Adquisición de imágenes
Las exploraciones se realizaron en un escáner Philips Achieva de 3T (Philips Medical Systems, Best, Países Bajos) utilizando una bobina de cabeza SENSE de 32 canales. Se adquirió una imagen estructural 3D ponderada en T1 para fines de registro anatómico . Se obtuvieron imágenes fMRI utilizando una secuencia de pulsos 3D PRESTO . Se adquirieron seis escaneos ficticios que fueron descartados por el escáner.
Preprocesamiento de imágenes
Los datos de fMRI fueron preprocesados utilizando el mapeo paramétrico estadístico (SPM12; Wellcome Trust Centre for Neuroimaging, University College London, London, UK2). Los escaneos de una sesión se realinearon con el primer escaneo para corregir el movimiento del sujeto utilizando un enfoque de mínimos cuadrados, una transformación espacial de seis parámetros (cuerpo rígido) y una estimación de B-spline de segundo grado. Los escaneos fueron co-registrados al T1 usando un modelo de cuerpo rígido. Los parámetros se estimaron mediante la función de información mutua normalizada. Las imágenes se reajustaron mediante una B-spline de 4º grado. El T1 se normalizó espacialmente en el espacio MNI estándar utilizando una regularización de sesgo muy ligera (0,0001) y una B-Spline de 4º grado. Los parámetros resultantes se aplicaron a todas las exploraciones funcionales para minimizar las diferencias anatómicas y, por tanto, permitir el análisis de grupos. Por último, todas las exploraciones se suavizaron espacialmente con un filtro gaussiano 3D (ancho completo a medio máximo: 8 mm) para minimizar aún más el efecto de las diferencias anatómicas funcionales.
Análisis individual de fMRI
Se realizó un análisis de regresión GLM relacionado con el evento para cada vóxel para generar mapas de activación individuales utilizando un enfoque de masa-univariante con un modelo de autocorrelación global aproximado AR(1), y un filtro de paso alto (corte de 128 s). La línea de base no se modeló explícitamente. La función básica fue una HRF canónica sin derivadas. Se utilizó un umbral de enmascaramiento de 0,8. Se utilizaron regresores separados para cada condición (CueE, 17 puntos de tiempo; CueD, 16 puntos de tiempo; StimE, 17 puntos de tiempo; StimD, 18 puntos de tiempo; y un regresor molesto para los períodos de blanc en la tarea relacionada con la secuencia m, 68 puntos de tiempo). No se excluyó ningún punto de tiempo del análisis. Los mapas beta se transformaron para reflejar el porcentaje real de cambio de señal en cada vóxel. Sólo presentamos los resultados para los regresores CueE y CueD, que reflejan los cambios de señal para las señales sin estímulo. Los mapas beta y estadísticos t se comprobaron visualmente para detectar artefactos importantes.
Análisis de fMRI de grupo
Se realizó un análisis de fMRI de segundo nivel con regresión lineal en cada vóxel para la visualización y la selección de la región de interés (ROI). Se realizó un análisis de ROI con el lenguaje de datos GNU (GDL3), utilizando mapas de cambio de señal porcentual de sujetos individuales generados por el análisis GLM. Los vóxeles dentro de una ROI o red se promediaron para calcular la diferencia de señal entre CueE, CueD y la línea de base.
Selección de ROI
Se determinaron los máximos y mínimos locales supratentoriales tanto para CueE como para CueD mediante SPM con un umbral no corregido (p < 0,001; Tabla 1). Se colocaron ROI cúbicas de tamaño y forma predefinidos sobre los máximos locales para el contraste CueE-línea base y CueD-línea base por separado dentro de una trama predefinida (Jansma y Rutten, 2017; Tabla 2). Los ROI se incluyeron en el análisis si contenían un máximo local significativo para CueE o CueD. Al definir los ROI en los máximos locales para ambas condiciones por separado, evitamos el sesgo hacia CueE o CueD. Además, la forma y el tamaño predefinidos de los ROI dentro de una trama reduce el efecto de la circularidad, porque los bordes de estos ROI no se ven afectados por el ruido (Kriegeskorte et al., 2009). Además, este método facilita la comparación cuantitativa de los resultados entre condiciones, y potencialmente entre diferentes estudios, facilitando así la reproducibilidad cuantitativa de los resultados de fMRI. La colocación de los ROIs sobre los máximos locales optimizó la potencia. Sin embargo, se sabe que la ubicación del pico de actividad se ve afectada por el ruido, por lo que la ubicación exacta de las ROIs puede reproducirse siempre para cada ROI. Esto no afecta a los resultados de la red ya que todas las ROIs se promedian y la ubicación exacta, por lo tanto, no es tan relevante.
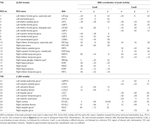
Tabla 1. Patrón de actividad.
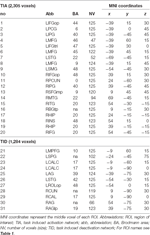
Tabla 2. Características de las regiones de interés (ROI).
Las ROIs sobre regiones con un aumento en el cambio de señal se combinaron en una red de activación inducida por la tarea («TIA»). Los ROIs sobre regiones con una disminución en el cambio de señal se combinaron en una red de desactivación inducida por la tarea («TID»; Tablas 1, 2). Cuando fue posible, los nombres de las ROI se determinaron utilizando el atlas AAL (Tzourio-Mazoyer et al., 2002).
La Tabla 2 y la Figura 2 proporcionan una visión general del tamaño y la ubicación de todas las ROI. Dado que el tamaño y los bordes de las ROI están predefinidos, es posible que la actividad media en la ROI no sea significativamente diferente de la línea de base, por ejemplo, porque el número de vóxeles activados dentro de la ROI es relativamente pequeño. Aunque la actividad media a nivel de red es significativamente diferente de la línea de base para todas las condiciones (Tabla 3), este no es el caso de ocho de las 31 ROIs individuales para CueE y tres de las 31 ROIs para CueD (Tabla 4). Sólo se incluyeron en el análisis los vóxeles que contenían señal para cada participante. El tamaño máximo de una ROI es de 125 vóxeles, algunas ROIs incluyen menos de 125 vóxeles porque están posicionadas cerca del cráneo.
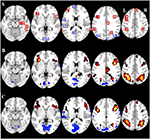
Figura 2. Visión general de la ubicación de la región de interés (ROI) y los resultados de fMRI de todo el cerebro. (A) ROIs para la activación inducida por la tarea (rojo) y la desactivación inducida por la tarea (azul) nota: ROI 22 no se muestra porque la ubicación está fuera de las rebanadas elegidas. Las coordenadas MNI, el número de BA y el tamaño de las ROI se pueden encontrar en la Tabla 2. (B) Representación visual de los valores t para CueE frente a la línea de base (≥3 = rojo a amarillo, ≤ -3 = azul a azul claro), (C) valores T para CueD frente a la línea de base (≥3 = rojo a amarillo, ≤ -3 = azul a azul claro). Las imágenes están en la orientación neurológica (L = izquierda, R = derecha), los nombres, las abreviaturas, las coordenadas MNI del voxel de las activaciones máximas se pueden encontrar en la Tabla 1.

Tabla 3. Resultados de la red.
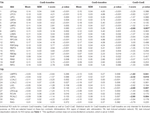
Tabla 4. Resultados del ROI.
Prueba de hipótesis
En este estudio probamos las siguientes hipótesis:
Hipótesis 1: La TIA mostrará un mayor cambio de señal para CueD, en comparación con CueE.
Hipótesis 2: TID mostrará un cambio de señal disminuido para CueD, en comparación con CueE.
Análisis estadístico
No se realizó un análisis de potencia ya que era la primera vez que se presentaba este diseño de tarea específico a los participantes. Por lo tanto, no se conoce el porcentaje de cambio de señal esperado ni la variabilidad de las condiciones (Desmond y Glover, 2002).
La precisión de la tarea se calculó para StimE y StimD como el porcentaje de respuestas correctas. Los tiempos de reacción se calcularon para StimE y StimD sobre todas las respuestas correctas.
Se utilizaron pruebas t de una muestra para comparar el porcentaje de cambio de señal para TIA y TID en comparación con la línea de base para CueE y CueD. Se utilizaron pruebas t de una muestra emparejada para comparar el cambio de señal, la precisión y las diferencias de tiempo de reacción entre CueD y CueE (Hipótesis 1 y 2).
Las pruebas post hoc implicaron pruebas t separadas para cada ROI dentro de cada red. El análisis de la ROI se corrigió con Bonferroni si la prueba ómnibus de la red no era significativa. Presentamos los valores p no corregidos y un comentario que indica si este valor p habría sobrevivido a la corrección de Bonferroni para todas las comparaciones múltiples. Se utilizó SPSS 24 para todos los análisis estadísticos.
Resultados
Rendimiento
La precisión para los estímulos fáciles («StimE») fue del 98% ± 1,2% SEM y para los estímulos difíciles («StimD») del 85% ± 2,6%. El tiempo de reacción para «StimE» fue de 682 ± 20 ms y para «StimD» de 1.138 ± 27 ms. Ambas condiciones muestran índices de precisión suficientes para confiar en que la tarea fue ejecutada según las instrucciones de todos los participantes. Como se hipotetizó, los participantes respondieron con menos precisión (T = -4,3, p < 0,001) y más lentamente (T = 17,8, p < 0,001) para la StimD que para la StimE (Figura 3), lo que indica que el contraste entre los estímulos fáciles y difíciles fue exitoso.
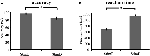
Figura 3. Resultados del rendimiento. (A) Precisión para ambas categorías de estímulo, (B) tiempo de reacción para ambas categorías de estímulo. Las barras de error representan el error estándar de la media (SEM). *p ≤ 0.001. Abreviaturas: EstímuloE, una pista que indica un estímulo fácil, seguida de un estímulo fácil; EstímuloD, una pista que indica un estímulo difícil, seguida de un estímulo difícil.
RM funcional
Descriptivos
La red TIA constaba de 20 ROIs, de las cuales 10 se basaban en máximos locales para CueE, cinco se basaban en máximos locales para CueD, y cinco contenían tanto un máximo de CueE como de CueD (Tabla 1). De estos 20 ROIs, 19 mostraron una actividad significativa en comparación con la línea de base para CueE, 18 para CueD (Tabla 1). El cambio de señal promedio en TIA en comparación con la línea de base para CueE fue de 0,12 ± 0,02 (t = 6,11, p < 0,001) y para CueD de 0,12 ± 0,02 (t = 7,61, p < 0,001).
La red TID consistía en 11 ROIs, de los cuales tres estaban basados en máximos locales para CueE, seis estaban basados en máximos locales para CueD, y dos contenían tanto un máximo de CueE como de CueD (Tabla 1). De estos 11 ROIs, cuatro mostraron una actividad significativa en comparación con la línea de base para CueE, 10 para CueD (Tabla 1). El cambio medio de la señal en TID en comparación con la línea de base para CueE fue -0,07 ± 0,02 (t = 2,68, p < 0,01), y para CueD -0,12 ± 0,02 (t = 5,37, p < 0,001; Tabla 3).
Sintonización con la dificultad esperada
El aumento de la señal en TIA no fue significativamente mayor para CueD en comparación con CueE (t = -0,24, p = 0,41), lo que indica que el nivel de activación de TIA no está sintonizado con la dificultad esperada (Figura 4, Tabla 3). El análisis post hoc de las ROIs no mostró ninguna de las 20 ROIs dentro del TIA con un aumento significativo de la señal para CueD en comparación con CueE después de aplicar la corrección de Bonferroni (Tabla 4, Figura 5).
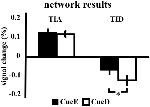
Figura 4. Resumen de los resultados de la red. Las barras de error representan el SEM. *p ≤ 0,05 para el taco difícil frente al taco fácil. Abreviaturas: TIA, red de activación inducida por la tarea; TID, red de desactivación inducida por la tarea; CueE, un cue que indica un estímulo fácil, no seguido por un estímulo; CueD, un cue que indica un estímulo difícil, no seguido por un estímulo.
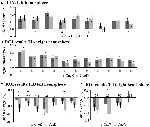
Figura 5. Visión general de las respuestas individuales de las ROI dentro de la red de activación inducida por la tarea, hemisferio izquierdo (A) y derecho (B), y desactivación inducida por la tarea, hemisferio izquierdo (C), y derecho (D). Las barras de error representan el SEM. *p ≤ 0,05 para CueD frente a CueE, véase la Figura 2 para la ubicación de los ROIs, véase la Tabla 1 para los nombres, abreviaturas y coordenadas MNI de los ROIs.
La disminución de la señal en TID fue significativamente más fuerte para CueD en comparación con CueE (T = -2,48, p = 0,01) lo que indica que el nivel de TID está sintonizado con la dificultad esperada (Tabla 3, Figura 4). El análisis post hoc de los ROIs mostró cuatro de los 11 ROIs de TID con una disminución significativa de la señal para CueD en comparación con CueE, a saber, LMPFG (T = -1,83, p = 0,04), LSPG (T = -2,32, p = 0,02), LSTG (T = -2,69, p < 0,01), y RCALC (T = -2,90, p < 0,01). Estos resultados indican que la sintonía con la dificultad esperada es más fuerte en los ROIs frontales, temporales y visuales izquierdos (Tabla 4, Figura 5).
Discusión
En este estudio, examinamos si el estado de alerta fásico está sintonizado con la dificultad esperada de un próximo desafío cognitivo y cómo lo está. El estado de alerta fásico se reflejó en regiones cerebrales activadas y desactivadas. La red activada incluía regiones de la red ejecutiva central. La red desactivada incluía regiones de la DMN, así como las cortezas visuales. El nivel de desactivación se ajustaba a la dificultad esperada del próximo estímulo, mientras que el nivel de activación no lo hacía. Estos resultados sugieren que la modulación del estado de alerta fásico se refleja predominantemente en los procesos de supresión gradual que son irrelevantes para la tarea actual (por ejemplo, los procesos cardiovagales, auditivos y visuales). Posiblemente, esto se debe a que estos procesos podrían interferir con los próximos retos cognitivos.
Los estudios de imagen anteriores sobre el estado de alerta fásico utilizaban un nivel de dificultad, sólo presentaban regiones cerebrales activadas (Shulman et al., 1999; Sturm y Willmes, 2001; Thiel et al., 2004; Fan et al., 2005; Périn et al., 2010; Yanaka et al., 2010), o se centraban únicamente en la actividad de la corteza visual (Bartolucci y Smith, 2011). Estos estudios han identificado una red fronto-parietal-talámica mayoritariamente lateralizada a la derecha, a veces combinada con regiones corticales motoras y visuales, que fue activada por una señal. Hay diferencias sustanciales en las redes activadas entre los estudios. Algunas de las diferencias entre las redes de los estudios anteriores pueden explicarse por la tarea que siguió a la señal. Por ejemplo, Thiel et al. (2004) sólo identificaron la activación en regiones corticales visuales utilizando una tarea de percepción visual, mientras que Fan et al. (2005) y Yanaka et al. (2010) identificaron la activación talámica y motora con una tarea de respuesta motora. Aunque Bartolucci y Smith (2011) presentan un elegante diseño de tarea con cuatro niveles de dificultad de una tarea de discriminación de la orientación, sólo presentaron la activación en la corteza visual. Por lo tanto, no está claro cómo respondieron otras regiones del cerebro en esta tarea. La red de activación inducida por la tarea, identificada en el estudio actual es más similar a la red encontrada por Shulman et al. (1999), que utilizaron un tipo similar de tarea de procesamiento visual.
No está claro si el estado de alerta fásico es una respuesta ascendente o descendente a una pista no informativa (Thiel et al., 2004; Hackley, 2009; Périn et al., 2010; Bartolucci y Smith, 2011; Chica et al., 2016). La alerta fásica ha sido considerada por algunos como una respuesta ascendente (Sturm et al., 1999; Hackley, 2009), por otros como descendente (Bartolucci y Smith, 2011), y por otros como una combinación (Thiel et al., 2004; Périn et al., 2010). Nosotros sostenemos que lo más adecuado es etiquetar la respuesta cerebral a una pista como una combinación de procesamiento ascendente y descendente porque los participantes responden tanto a una pista externa como a una instrucción asociada a esta pista. Sin embargo, nuestros principales resultados se refieren a la diferencia en la respuesta a dos pistas similares que indican un tipo diferente de estímulo de la tarea. Por lo tanto, argumentamos que la diferencia resultante entre la señal que indica una tarea difícil y la señal que indica una tarea fácil puede representar un nivel de control descendente relacionado con la interpretación de la señal y la instrucción asociada.
La red de desactivación inducida por la tarea incluyó regiones cerebrales de la DMN, a saber, el giro prefrontal medial, el giro temporal superior y el giro angular (Shulman et al., 1999; Raichle et al., 2001; Raichle, 2015). Se suele hipotetizar que la desactivación de la DMN ayuda al rendimiento de la tarea al reducir los procesos internos que interfieren con los retos cognitivos (Raichle et al., 2001; Buckner et al., 2008; Raichle, 2015). Este punto de vista es apoyado por estudios que muestran que el nivel de desactivación de la DMN escala con la dificultad de una tarea durante su ejecución (McKiernan et al., 2003; Singh y Fawcett, 2008). Estos estudios examinaron la desactivación durante la ejecución de la tarea. Nuestros resultados sugieren que este escalamiento puede ocurrir ya durante la fase de anticipación de la tarea. Weissman et al. (2006) examinaron la variabilidad de los tiempos de reacción individuales para identificar lapsos de atención. Los lapsos de atención podrían estar asociados a una menor desactivación de la DMN. Mientras que (Weissman et al., 2006) examinaron la variación natural en el nivel de alerta, nuestros resultados indican que la desactivación en varias regiones de la DMN también puede ser sintonizada de manera descendente antes de que se presente el estímulo de la tarea.
Los efectos de sintonización más profundos se encontraron en las regiones prefrontal medial izquierda, temporal y visual. A continuación se discuten las posibles implicaciones de estos efectos para estas regiones en relación con su función propuesta.
La actividad de la corteza prefrontal medial se ha asociado previamente con el vagabundeo mental (Bertossi et al., 2017), la recuperación de la memoria (Euston et al., 2012) y el control cardiovagal (Wong et al., 2007). Esta desactivación prefrontal medial sugiere que cualquiera de estas funciones ya está suprimida en previsión de un desafío cognitivo.
La sintonía de la desactivación con la dificultad esperada en las regiones visuales y temporales puede estar relacionada con la supresión de la entrada sensorial visual y auditiva irrelevante. La sintonización en las regiones temporales bilaterales puede estar relacionada específicamente con la supresión del ruido generado por el escáner de IRM. Es razonable esperar que el nivel de sonido sea similar entre las condiciones. El hecho de que el nivel de desactivación sea más fuerte para las señales difíciles sugiere que el procesamiento del sonido ambiental se suprime más fuertemente si se espera una tarea difícil. La desactivación en las cortezas visuales es menos frecuente que la desactivación en las regiones temporales. Sin embargo, Smith et al. (2000) han informado previamente de una asociación entre la desactivación generalizada en la corteza visual y la atención a una parte específica de una imagen. Giesbrecht et al. (2006) también informaron de la modulación de la activación visual asociada a la atención encubierta a objetos cercanos al centro del campo visual en comparación con los objetos del campo visual periférico. Estos hallazgos indican que la activación en las cortezas visuales puede ser modulada por la atención encubierta a regiones foveales o periféricas. Nuestro estudio añade una nueva dimensión a estos hallazgos, ya que sugiere que la activación en las cortezas visuales no sólo está modulada por la localización de la atención visual encubierta, sino también por la dificultad esperada de un desafío visual; y puesto que las señales eran idénticas en localización y tamaño, este proceso parece estar regulado de forma descendente.
También identificamos un conjunto de regiones cerebrales que mostraron una mayor activación en previsión de un desafío cognitivo. Esta red mostró similitudes con la red ejecutiva central que se ha asociado previamente con la ejecución de tareas de memoria de trabajo (Lawrence et al., 2003). Sin embargo, la activación en esta red no estaba sintonizada con la dificultad esperada de la tarea. Esto sugiere que estas regiones representan procesos que son similares para la condición difícil y fácil. Posiblemente, la actividad en esta red está asociada con la evaluación de la pista, o la recuperación y el mantenimiento del contexto de la tarea y las instrucciones.
Hay que tener en cuenta algunas limitaciones que pueden afectar a la interpretación de nuestros resultados. En primer lugar, no incluimos ensayos con estímulos que no estuvieran precedidos por una clave, por lo que no es posible examinar el efecto de la clave en el rendimiento cognitivo. Debido a la restricción de tiempo, no fue posible repetir nuestra tarea utilizando estímulos idénticos pero sin pistas.
En segundo lugar, utilizamos un signo de exclamación como parte de la pista que indicaba un desafío cognitivo difícil porque este símbolo se utiliza típicamente si hay una necesidad de aumentar el estado de alerta. Es posible que el signo de exclamación en sí mismo pueda haber jugado un papel en los diferentes patrones de activación para la condición fácil y difícil, debido a su significado inherente. Sin embargo, esto no afecta a la interpretación principal de nuestros resultados, excepto que nuestros resultados principales pueden clasificarse como una respuesta ascendente en lugar de una respuesta descendente. Por último, nuestro diseño experimental no nos permite examinar si la actividad relacionada con la alerta fásica puede generalizarse a otros dominios, o si es específica de un dominio, ya que sólo incluía un desafío cognitivo visuo-perceptivo.
Para concluir, en este estudio hemos demostrado que la sintonía de la alerta fásica está representada por el nivel de desactivación en varias regiones. Este efecto es más fuerte en la corteza prefrontal medial, visual y temporal, lo que puede reflejar una supresión del control cardiovagal, el procesamiento visual en el campo visual periférico y la supresión del ruido del escáner de resonancia magnética. Estos resultados sugieren que el rendimiento cognitivo se ve facilitado por un estado del cerebro estrechamente vinculado a las expectativas sobre la dificultad de un próximo desafío cognitivo.
Disponibilidad de datos
Los datos crudos se generaron en el hospital Elisabeth-Tweesteden. Los datos derivados que apoyan los hallazgos de este estudio están disponibles a través del autor correspondiente, previa solicitud razonable.
Declaración ética
Este estudio se llevó a cabo de acuerdo con las recomendaciones de la ley holandesa de apoyo social, comité ético médico Brabant. Todos los sujetos dieron su consentimiento informado por escrito de acuerdo con la Declaración de Helsinki. El protocolo fue aprobado por el comité ético médico Brabant.
Contribuciones de los autores
MD y JJ escribieron el manuscrito principal y prepararon las figuras. MD y IS realizaron los experimentos. G-JR, NR, y JJ supervisó conjuntamente el trabajo. Todos los autores revisaron el manuscrito.
Financiación
Este estudio ha sido financiado por ZonMW, una organización nacional holandesa (Organización Holandesa para la Investigación y el Desarrollo de la Salud, ZONMW; número de proyecto: 842003004), título del proyecto: Implementación clínica de técnicas avanzadas de resonancia magnética para la localización y el seguimiento de las funciones sensoriomotoras y cognitivas en pacientes con tumores cerebrales.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Agradecimientos
Deseamos agradecer a los radiógrafos William Pigmans y Maikel Brands su contribución a este estudio.
Abreviaturas
DMN, red de modo por defecto; M, hombre; F, mujer; GLM, modelo lineal general; SPM, mapeo paramétrico estadístico; CueE, un cue que indica un estímulo fácil, no seguido por un estímulo; CueD, un cue que indica un estímulo difícil, no seguido por un estímulo; StimE, señal que indica un estímulo fácil, seguido de un estímulo fácil; StimD, señal que indica un estímulo difícil, seguido de un estímulo difícil; MRI, imagen de resonancia magnética; ROI, región de interés; GDL, lenguaje de datos GNU; TIA, red de activación inducida por la tarea; TID, red de desactivación inducida por la tarea; SEM, error estándar de la media.
Notas
- ^ https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/project-detail/topzorg/clinical-implementation-of-advanced-mri-techniques-for-localization-and-monitoring-of-sensorimotor-a/verslagen/
- ^ http://www.fil.ion.ucl.ac.uk/spm/software/spm12/
- ^ https://github.com/gnudatalanguage/gdl
Bartolucci, M., y Smith, A. T. (2011). La modulación atencional en la corteza visual se modifica durante el aprendizaje perceptivo. Neuropsychologia 49, 3898-3907. doi: 10.1016/j.neuropsychologia.2011.10.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bertossi, E., Peccenini, L., Solmi, A., Avenanti, A., y Ciaramelli, E. (2017). La estimulación transcraneal de corriente directa de la corteza prefrontal medial amortigua el vagabundeo mental en los hombres. Sci. Rep. 7:16962. doi: 10.1038/s41598-017-17267-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Buckner, R. L., Andrews-Hanna, J. R., y Schacter, D. L. (2008). La red por defecto del cerebro: anatomía, función y relevancia para la enfermedad. Ann. N Y Acad. Sci. 1124, 1-38. doi: 10.1196/annals.1440.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Buracas, G. T., y Boynton, G. M. (2002). Efficient design of event-related fMRI experiments using M-sequences. Neuroimage 16, 801-813. doi: 10.1006/nimg.2002.1116
PubMed Abstract | CrossRef Full Text | Google Scholar
Čeko, M., Gracely, J. L., Fitzcharles, M. A., Seminowicz, D. A., Schweinhardt, P., y Bushnell, M. C. (2015). Se requiere una red de modo por defecto de respuesta para el desempeño exitoso de la tarea de memoria de trabajo? J. Neurosci. 35, 11595-11605. doi: 10.1523/JNEUROSCI.0264-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Chica, A. B., Bayle, D. J., Botta, F., Bartolomeo, P., y Paz-Alonso, P. M. (2016). Interacciones entre la alerta fásica y la conciencia en la red fronto-estriatal. Sci. Rep. 6:13. doi: 10.1038/srep31868
PubMed Abstract | CrossRef Full Text | Google Scholar
Desmond, J. E., y Glover, G. H. (2002). Estimación del tamaño de la muestra en estudios de neuroimagen de resonancia magnética funcional (fMRI): análisis de potencia estadística. J. Neurosci. Methods 118, 115-128. doi: 10.1016/s0165-0270(02)00121-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Euston, D. R., Gruber, A. J., and McNaughton, B. L. (2012). El papel de la corteza prefrontal medial en la memoria y la toma de decisiones. Neuron 76, 1057-1070. doi: 10.1016/j.neuron.2012.12.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Fossella, J., Flombaum, J. I., y Posner, M. I. (2005). La activación de las redes atencionales. Neuroimage 26, 471-479. doi: 10.1016/j.neuroimage.2005.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Sommer, T., Raz, A., y Posner, M. I. (2002). Testing the efficiency and independence of attentional networks. J. Cogn. Neurosci. 14, 340-347. doi: 10.1162/089892902317361886
PubMed Abstract | CrossRef Full Text | Google Scholar
Giesbrecht, B., Weissman, D. H., Woldorff, M. G., y Mangun, G. R. (2006). La actividad previa al objetivo en la corteza visual predice el rendimiento conductual en tareas de atención espacial y de rasgos. Brain Res. 1080, 63-72. doi: 10.1016/j.brainres.2005.09.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Hackley, S. A. (2009). La aceleración de la reacción voluntaria por una señal de advertencia. Psychophysiology 46, 225-233. doi: 10.1111/j.1469-8986.2008.00716.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Härmä, M., Partinen, M., Repo, R., Sorsa, M., and Siivonen, P. (2008). Effects of 6/6 and 4/8 watch systems on sleepiness among bridge officers. Chronobiol. Int. 25, 413-423. doi: 10.1080/07420520802106769
PubMed Abstract | CrossRef Full Text | Google Scholar
Hedden, T., Van Dijk, K. R., Shire, E. H., Sperling, R. A., Johnson, K. A., and Buckner, R. L. (2012). Fallo en la modulación del control atencional en el envejecimiento avanzado vinculado a la patología de la materia blanca. Cereb. Cortex 22, 1038-1051. doi: 10.1093/cercor/bhr172
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., Ramsey, N. F., de Zwart, J. A., van Gelderen, P., and Duyn, J. H. (2007). fMRI study of effort and information processing in a working memory task. Hum. Brain Mapp. 27, 431-440. doi: 10.1002/hbm.20297
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., y Rutten, G. J. (2017). «Una propuesta para un sistema que facilita la replicación cuantitativa de los estudios de fMRI», en Proceedings of the Human Brain Mapping Conference 2017 June 25-29, Vancouver, Canada. Disponible en línea en: https://archive.aievolution.com/2017/hbm1701/index.cfm?do=abs.viewAbs&abs=4047.
Google Scholar
Kriegeskorte, N., Simmons, W. K., Bellgowan, P. S., y Baker, C. I. (2009). El análisis circular en la neurociencia de sistemas: los peligros de la doble inmersión. Nat. Neurosci. 12, 535-540. doi: 10.1038/nn.2303
PubMed Abstract | CrossRef Full Text | Google Scholar
Kusnir, F., Chica, A. B., Mitsumasu, M. A., y Bartolomeo, P. (2011). La alerta auditiva fásica mejora la percepción visual consciente. Conscious. Cogn. 20, 1201-1210. doi: 10.1016/j.concog.2011.01.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Lawrence, M. A., Ross, T. J., Hoffmann, H. G., y Stein, E. S. (2003). Múltiples redes neuronales median la atención sostenida. J. Cogn. Neurosci. 15, 1028-1038. doi: 10.1162/089892903770007416
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, G., Sobering, G., Duyn, J., y Moonen, C. T. (1993). A functional MRI technique combining principles of echo-shifting with a train of observations (PRESTO). Magn. Reson. Med. 30, 764-768. doi: 10.1002/mrm.1910300617
PubMed Abstract | CrossRef Full Text | Google Scholar
Macleod, J. W., Lawrence, M. A., McConnell, M. M., Eskes, G. A., Klein, R. M., and Shore, D. I. (2010). Apreciando el ANT: consideraciones psicométricas y teóricas de la prueba de la red de atención. Neuropsicología 24, 637-651. doi: 10.1037/a0019803
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., D’Angelo, B. R. D., Kaufman, J. N., y Binder, J. R. (2006). Interrupción de la «corriente de conciencia»: una investigación de fMRI. Neuroimage 29, 1185-1191. doi: 10.1016/j.neuroimage.2005.09.030
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., Kaufman, J. N., Kucera-Thompson, J. K., y Binder, J. R. (2003). Una manipulación paramétrica de los factores que afectan a la desactivación inducida por la tarea en la neuroimagen funcional. J. Cogn. Neurosci. 15, 394-408. doi: 10.1162/089892903321593117
PubMed Abstract | CrossRef Full Text | Google Scholar
Nebes, R. D., y Brady, C. B. (1993). Alerta fásica y tónica en la enfermedad de Alzheimer. Cortex 29, 77-90. doi: 10.1016/s0010-9452(13)80213-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Neggers, S. F., Hermans, E. J., y Ramsey, N. F. (2008). Enhanced sensitivity with fast three-dimensional blood-oxygen-level-dependent functional MRI: comparison of SENSE-PRESTO and 2D-EPI at 3 T. NMR Biomed. 21, 663-676. doi: 10.1002/nbm.1235
PubMed Abstract | CrossRef Full Text | Google Scholar
Périn, B., Godefroy, O., Fall, S., and de Marco, G. (2010). Alertness in young healthy subjects: an fMRI study of brain region interactivity enhanced by a warning signal. Brain Cogn. 72, 271-281. doi: 10.1016/j.bandc.2009.09.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pyka, M., Beckmann, C. F., Schöning, S., Hauke, S., Heider, D., Kugel, H., et al. (2009). Impacto de la carga de la memoria de trabajo en el patrón de estado de reposo FMRI en las fases de reposo posteriores. PLoS One 4:e7198. doi: 10.1371/journal.pone.0007198
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E. (2015). La red de modos por defecto del cerebro. Annu. Rev. Neurosci. 38, 433-447. doi: 10.1146/annurev-neuro-071013-014030
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E., MacLeod, J. W., Snyder, A. Z., Powers, W. J., Gusnard, D. A., y Shulman, G. L. (2001). A default mode of brain function. Proc. Natl. Acad. Sci. U S A 98, 676-682. doi: 10.1073/pnas.98.2.676
PubMed Abstract | CrossRef Full Text | Google Scholar
Shulman, G. L., Ollinger, J. M., Akbudak, E., Conturo, T. E., Snyder, A. Z., Petersen, S. E., et al. (1999). Areas involved in encoding and applying directional expectations to moving objects. J. Neurosci. 19, 9480-9496. doi: 10.1523/jneurosci.19-21-09480.1999
PubMed Abstract | CrossRef Full Text | Google Scholar
Singh, K. D., and Fawcett, I. P. (2008). Transient and linearly graded deactivation of the human default-mode network by a visual detection task. Neuroimage 41, 100-112. doi: 10.1016/j.neuroimage.2008.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, A. T., Singh, K. D., y Greenlee, M. W. (2000). Attentional suppression of activity in the human visual cortex. Neuroreport 11, 271-277. doi: 10.1097/00001756-200002070-00010
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., de Simone, A., Krause, B. J., Specht, K., Hessemann, V., Radermacher, I., et al. (1999). Functional anatomy of intrinsic alertness: evidence for a froto-parietal-thalamic-brainstem network in the right hemisphere. Neuropsychologia 37, 797-805. doi: 10.1016/s0028-3932(98)00141-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., y Willmes, K. (2001). Sobre la neuroanatomía funcional del estado de alerta intrínseco y fásico. Neuroimage 14, S76-S84. doi: 10.1006/nimg.2001.0839
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, C. M., Zilles, K., y Fink, G. R. (2004). Cerebral correlates of alerting, orienting and reorienting of visuospatial attention: an event-related fMRI study. Neuroimage 21, 318-328. doi: 10.1016/j.neuroimage.2003.08.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Etiquetado anatómico automatizado de las activaciones en SPM utilizando una parcelación anatómica macroscópica del cerebro de un solo sujeto de MNI MRI. Neuroimage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
van Gelderen, P., Ramsey, N. F., Liu, G., Duyn, J. H., Frank, J. A., Weinberger, D. R., et al. (1995). Three-dimensional functional magnetic resonance imaging of human brain on a clinical 1.5-T scanner. Proc. Natl. Acad. Sci. U S A 92, 6906-6910. doi: 10.1073/pnas.92.15.6906
PubMed Abstract | CrossRef Full Text | Google Scholar
Weinbach, N., and Henik, A. (2011). El estado de alerta fásico puede modular el control ejecutivo mediante la mejora del procesamiento global de los estímulos visuales. Cognition 121, 454-458. doi: 10.1016/j.cognition.2011.08.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Weissman, D. H., Roberts, K. C., Visscher, K. M., y Woldorff, M. G. (2006). The neural bases of momentary lapses in attention. Nat. Neurosci. 9, 971-978. doi: 10.1038/nn1727
PubMed Abstract | CrossRef Full Text | Google Scholar
Wong, S. W., Massé, N., Kimmerly, D. S., Menon, R. S., y Shoemaker, J. K. (2007). Ventral medial prefrontal cortex and cardiovagal control in conscious humans. Neuroimage 35, 698-708. doi: 10.1016/j.neuroimage.2006.12.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanaka, H. T., Saito, D. N., Uchiyama, Y., y Sadato, N. (2010). Neural substrates of phasic alertness: a functional magnetic resonance imaging study. Neurosci. Res. 68, 51-58. doi: 10.1016/j.neures.2010.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
.