Introduzione
Ricerche precedenti dimostrano che le persone possono usare un segnale per prepararsi mentalmente a una sfida cognitiva. Se i partecipanti sono istruiti a prepararsi mentalmente nel momento in cui viene presentato un indizio, questo è stato definito come allerta fasica. La capacità di influenzare il nostro livello di allerta potrebbe essere importante, in particolare se l’allerta ha anche un costo. Se la richiesta di attenzione è troppo alta, questo potrebbe potenzialmente portare alla fatica (Härmä et al., 2008) o a problemi legati allo stress. In questo studio, ci proponiamo di esaminare se e come gli adulti sani sintonizzano il loro livello di attenzione sulla difficoltà prevista di un compito cognitivo imminente.
Se un segnale viene presentato appena prima di uno stimolo, le persone sono generalmente in grado di rispondere più velocemente in semplici compiti di risposta motoria (Fan et al., 2002; Macleod et al., 2010; Weinbach e Henik, 2011) e percepiscono più accuratamente gli stimoli visivi degradati (Kusnir et al., 2011). Gli studi di imaging hanno dimostrato che l’allerta fasica è associata a una maggiore attivazione nelle regioni frontali, parietali, talamiche (Shulman et al., 1999; Fan et al., 2005; Yanaka et al., 2010), temporo-occipitali (Thiel et al., 2004) e visive del cervello (Bartolucci e Smith, 2011). Questi studi di imaging hanno fornito informazioni preziose sulla rappresentazione della vigilanza fasica nel cervello. Tuttavia, la vigilanza fasica è stata generalmente studiata come un fenomeno on/off o l’analisi è stata limitata alla corteccia visiva. Pertanto, non è chiaro se la vigilanza riflette anche la difficoltà prevista della sfida cognitiva in intere reti cerebrali.
Inoltre, studi precedenti hanno indicato che la disattivazione delle regioni cerebrali che fanno parte della rete di modalità predefinita (DMN) può facilitare l’esecuzione del compito cognitivo. In primo luogo, gli studi sull’esecuzione dei compiti mostrano che un livello crescente di difficoltà del compito è associato a una crescente disattivazione (McKiernan et al., 2003, 2006; Jansma et al., 2007; Singh e Fawcett, 2008; Pyka et al., 2009; Hedden et al., 2012; Čeko et al., 2015). In secondo luogo, Jansma et al. (2007) hanno dimostrato che la parte prefrontale mediale del DMN si accorda solo alla difficoltà del compito, che il partecipante poteva anticipare, ma non era influenzata dalla difficoltà effettiva di ogni stimolo, che il partecipante non poteva anticipare. Infine, Weissman et al. (2006) hanno trovato che la disattivazione nella DMN appena prima dello stimolo era più debole se i soggetti rispondevano relativamente lentamente. Forse questi soggetti hanno risposto più lentamente perché erano temporaneamente meno attenti.
Per il nostro studio, abbiamo progettato un compito di percezione visiva con una condizione facile e difficile. Le indicazioni fornivano informazioni sulla difficoltà dello stimolo imminente, ma non fornivano alcuna informazione che potesse facilitare il compito stesso. Nella metà delle prove, la stecca non era seguita da uno stimolo. Solo queste prove sono state analizzate per l’attività cerebrale in modo da poter isolare completamente l’attivazione associata con il segnale, dall’attivazione associata all’esecuzione del compito. Ipotizziamo che i partecipanti sintonizzino la loro attività sulla difficoltà prevista del compito.
Materiali e metodi
Partecipanti
I partecipanti sono stati reclutati tramite pubblicità online. I partecipanti sono stati esclusi se hanno riportato una storia di significativi disturbi neurologici o psichiatrici, o controindicazioni per la risonanza magnetica (MRI) (oggetti metallici nel o intorno al corpo, claustrofobia, o gravidanza). Questo studio è stato condotto in conformità con le raccomandazioni del Medical Research Involving Human Subjects Act (WMO), Medical Research Ethics Committee Brabant. Il protocollo è stato approvato dal Comitato etico della ricerca medica (numero di protocollo: NL51147.028.14). Tutti i soggetti hanno dato il consenso informato scritto in conformità con la Dichiarazione di Helsinki.
Ventidue volontari destri sani hanno partecipato allo studio. I dati di due partecipanti sono stati esclusi a causa di artefatti dello scanner. I risultati sono riportati per i restanti 20 partecipanti.
Task Design
Abbiamo progettato un compito (con design evento-correlato) che ci ha permesso di esaminare gli effetti di anticipazione relativi alla difficoltà prevista di un compito, senza effetti confondenti di esecuzione del compito.
Stimoli compito consisteva di nove frecce in un layout tre per tre su uno schermo nero (Figura 1). Uno “stimolo facile” conteneva otto frecce nella direzione corretta e una freccia nella direzione opposta. Uno “stimolo difficile” conteneva cinque frecce nella direzione corretta e quattro nella direzione opposta (Figura 1). I partecipanti sono stati istruiti a premere un pulsante con la mano corrispondente alla direzione della maggior parte delle frecce. Gli stimoli facili e difficili sono stati presentati in ordine casuale. Gli stimoli di base consistevano in uno schermo nero fermo con il testo: “hai una pausa di 30 s” in olandese e in lettere bianche. Gli stimoli sono stati presentati dal software “presentation”.
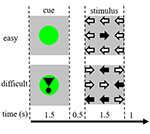
Figura 1. Rappresentazione degli stimoli visivi. Ogni prova era di 4,5 s. Nella metà delle prove il segnale non era seguito da uno stimolo. Queste prove sono state utilizzate per l’analisi della risonanza magnetica funzionale (fMRI).
Ogni prova è iniziata con un segnale che indicava la difficoltà dello stimolo presentato successivamente. Un punto verde indicava uno “stimolo facile”, un punto verde con un punto esclamativo indicava uno “stimolo difficile” (Figura 1).
Nella metà dei trial, il cue non era seguito da uno stimolo, nell’altra metà lo stimolo veniva presentato 500 ms dopo la scomparsa del cue. Questo ha portato a quattro condizioni: (1) un segnale per uno stimolo facile, non seguito da uno stimolo (“CueE”); (2) un segnale per uno stimolo difficile, non seguito da uno stimolo (“CueD”); (3) un segnale per uno stimolo facile, seguito da uno stimolo facile (“StimE”); e (4) un segnale per uno stimolo difficile, seguito da uno stimolo difficile (“StimD”). Tutte le condizioni sono state contrapposte alla linea di base. I risultati della risonanza magnetica funzionale (fMRI) erano basati su CueE e CueD. I risultati delle prestazioni erano basati su StimE e StimD. CueE e CueD sono stati presentati in un ordine pseudocasuale utilizzando sequenze M per massimizzare l’indipendenza dei regressori del modello lineare generale (GLM) tra le condizioni e ottimizzare l’efficienza del progetto (Buracas e Boynton, 2002). I partecipanti non potevano prevedere se uno spunto sarebbe stato seguito da uno stimolo o meno.
La durata di ogni prova era di 4.500 ms. Gli spunti sono stati presentati a t = 0 per 1.500 ms e gli stimoli sono stati presentati a t = 2.000, sempre per 1.500 ms (Figura 1). Il compito è stato eseguito in due corse di 68 prove. La linea di base consisteva in tre periodi di riposo di 30 s, prima, dopo e tra le due corse. La durata totale del compito è stata di 11,7 min. Questo è stato il secondo compito della sessione ed è iniziato dopo che i partecipanti sono stati sdraiati circa 10 min nello scanner.
I partecipanti sono stati istruiti a prepararsi per uno stimolo facile o difficile in base alle informazioni del cue (Figura 1) e a indicare il più accuratamente e rapidamente possibile la direzione della maggior parte delle frecce nello stimolo. I partecipanti si sono esercitati nel compito fuori dallo scanner seguendo un protocollo di pratica standard di 3 minuti. Questo protocollo è stato ripetuto se le prestazioni erano insufficienti (sotto il 70% di precisione per gli stimoli difficili).
Uno specchio collegato alla bobina della testa ha permesso ai partecipanti di vedere uno schermo di proiezione trasparente posizionato dietro la testa. Un videoproiettore all’interno della stanza dello scanner proiettava gli stimoli del compito sullo schermo. Due pulsantiere pneumatiche a pressione d’aria sono state utilizzate per registrare le risposte. I partecipanti hanno usato il pollice o l’indice sinistro per rispondere “a sinistra” e il destro per rispondere “a destra”.
Acquisizione delle immagini
Le scansioni sono state eseguite su uno scanner Philips Achieva 3T (Philips Medical Systems, Best, Paesi Bassi) utilizzando una bobina di testa SENSE a 32 canali. Un’immagine strutturale pesata in T1 3D è stata acquisita per scopi di registrazione anatomica. Le immagini fMRI sono state ottenute utilizzando una sequenza di impulsi PRESTO 3D. Sei scansioni fittizie sono state acquisite e poi scartate dallo scanner.
Image Pre-processing
I dati fMRI sono stati preprocessati utilizzando la mappatura parametrica statistica (SPM12; Wellcome Trust Centre for Neuroimaging, University College London, Londra, UK2). Scansioni da una sessione sono stati riallineati alla prima scansione per correggere il movimento del soggetto utilizzando un approccio minimi quadrati, un sei parametri (corpo rigido) trasformazione spaziale, e un 2 ° grado B-spline stima. Le scansioni sono state co-registrate alla T1 usando un modello di corpo rigido. I parametri sono stati stimati dalla funzione di mutua informazione normalizzata. Le immagini sono state reimpostate con una B-spline di 4° grado. Il T1 è stato normalizzato spazialmente nello spazio MNI standard usando una regolarizzazione di bias molto leggera (0,0001) e una B-Spline di 4° grado. I parametri risultanti sono stati applicati a tutte le scansioni funzionali per minimizzare le differenze anatomiche e quindi permettere l’analisi di gruppo. Infine, tutte le scansioni sono state lisciate spazialmente con un filtro gaussiano 3D (full-width at half-maximum: 8 mm) per minimizzare ulteriormente l’effetto delle differenze anatomiche funzionali.
Analisi fMRI individuale
L’analisi di regressione GLM correlata agli eventi è stata eseguita per ogni voxel per generare mappe di attivazione individuale utilizzando un approccio di massa-univariato con un modello di autocorrelazione AR(1) approssimato globale, e un filtro passa alto (128 s cut-off). La linea di base non è stata esplicitamente modellata. La funzione di base era una HRF canonica senza derivate. È stata usata una soglia di mascheramento di 0,8. Regressori separati sono stati utilizzati per ogni condizione (CueE, 17 timepoints; CueD, 16 timepoints; StimE, 17 timepoints; StimD, 18 timepoints; e un regressore di disturbo per periodi di blanc nel compito relativo alla sequenza m, 68 timepoints). Nessun timepoint è stato escluso dall’analisi. Le mappe beta sono state trasformate per riflettere l’effettivo cambiamento di segnale percentuale in ogni voxel. Presentiamo solo i risultati per i regressori CueE e CueD, che riflettono i cambiamenti di segnale per le indicazioni senza uno stimolo. Beta e t-map statistici sono stati controllati visivamente per artefatti importanti.
Analisi fMRI di gruppo
Un’analisi fMRI di secondo livello è stata eseguita con regressione lineare in ogni voxel per la visualizzazione e la selezione della regione di interesse (ROI). Un’analisi ROI è stata eseguita con GNU data language (GDL3), utilizzando le mappe di variazione del segnale percentuale del singolo soggetto generate dall’analisi GLM. I voxel all’interno di un ROI o rete sono stati mediati per calcolare la differenza di segnale tra CueE, CueD, e baseline.
Selezione ROI
Supratentorial massimi e minimi locali sono stati determinati sia per CueE e CueD da SPM con una soglia non corretta (p < 0.001; Tabella 1). ROI cubiche di forma e dimensioni predefinite sono state collocate sopra i massimi locali per il contrasto CueE-baseline e CueD-baseline separatamente all’interno di un raster predefinito (Jansma e Rutten, 2017; Tabella 2). Le ROI sono state incluse nell’analisi se contenevano un massimo locale significativo per CueE o CueD. Definendo le ROI sui massimi locali per entrambe le condizioni separatamente, impediamo la distorsione verso CueE o CueD. Inoltre, la forma e la dimensione predefinita delle ROI all’interno di un raster riduce l’effetto della circolarità, perché i confini di queste ROI non sono influenzati dal rumore (Kriegeskorte et al., 2009). Inoltre, questo metodo facilita il confronto quantitativo dei risultati tra le condizioni, e potenzialmente tra diversi studi, facilitando così la riproducibilità quantitativa dei risultati fMRI. Posizionamento delle ROI sopra i massimi locali ottimizzato potenza. Tuttavia, la posizione del picco di attività è noto per essere influenzato dal rumore, quindi la posizione esatta delle ROI può sempre riprodurre per ogni ROI. Questo non influisce sui risultati della rete poiché tutte le ROI sono mediate e la posizione esatta, quindi, non è così rilevante.
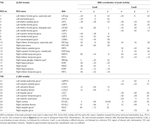
Tabella 1. Modello di attività.
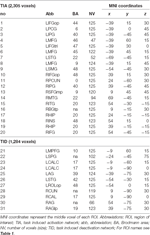
Tabella 2. Caratteristiche delle regioni di interesse (ROI).
Le ROI sulle regioni con un aumento della variazione del segnale sono state combinate in una rete di attivazione indotta dal compito (“TIA”). Le ROI sulle regioni con una diminuzione del segnale sono state combinate in una rete di disattivazione indotta dal compito (“TID”; Tabelle 1, 2). Dove possibile, i nomi delle ROI sono stati determinati utilizzando l’atlante AAL (Tzourio-Mazoyer et al., 2002).
Tabella 2 e Figura 2 forniscono una panoramica delle dimensioni e della posizione di tutte le ROI. Poiché la dimensione e i confini delle ROI sono predefiniti, è possibile che l’attività media nella ROI non sia significativamente diversa dalla linea di base, per esempio perché il numero di voxel attivati all’interno della ROI è relativamente piccolo. Anche se l’attività media a livello di rete è significativamente diversa dalla linea di base per tutte le condizioni (Tabella 3), questo non è il caso per otto delle 31 ROI individuali per CueE e tre delle 31 ROI per CueD (Tabella 4). Solo i voxel che contenevano il segnale per ogni partecipante sono stati inclusi nell’analisi. La dimensione massima di una ROI è di 125 voxel, alcune ROI includono meno di 125 voxel perché sono posizionate vicino al cranio.
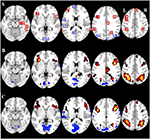
Figura 2. Panoramica della regione di interesse (ROI) posizione e risultati fMRI cervello intero. (A) ROI per l’attivazione indotta compito (rosso) e compito indotto disattivazione (blu) nota: ROI 22 non viene visualizzato perché la posizione è al di fuori delle fette scelte. Le coordinate MNI, il numero BA e le dimensioni delle ROI possono essere trovati nella tabella 2. (B) Rappresentazione visiva dei valori t per CueE vs linea di base (≥3 = rosso al giallo, ≤ -3 = blu al blu chiaro), (C) T-valori per CueD vs linea di base (≥3 = rosso al giallo, ≤ -3 = blu al blu chiaro). Le immagini sono in orientamento neurologico (L = sinistra, R = destra), i nomi, le abbreviazioni, le coordinate MNI del voxel delle attivazioni di picco si trovano nella tabella 1.

Tabella 3. Risultati della rete.
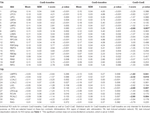
Tabella 4. Risultati ROI.
Test delle ipotesi
Abbiamo testato le seguenti ipotesi in questo studio:
Ipotesi 1: TIA mostrerà un cambiamento di segnale maggiore per CueD, rispetto a CueE.
Ipotesi 2: TID mostrerà una diminuzione del cambiamento del segnale per CueD, rispetto a CueE.
Analisi statistica
L’analisi della potenza non è stata eseguita poiché era la prima volta che questo specifico disegno del compito veniva presentato ai partecipanti. Pertanto non si conosce la percentuale prevista di cambiamento del segnale e la variabilità delle condizioni (Desmond e Glover, 2002).
L’accuratezza del compito è stata calcolata per StimE e StimD come percentuale di risposte corrette. I tempi di reazione sono stati calcolati per StimE e StimD su tutte le risposte corrette.
Sono stati utilizzati i test t a un campione per confrontare la variazione percentuale del segnale per TIA e TID rispetto alla linea di base per CueE e CueD. Sono stati utilizzati test t-test unilaterali a coppie per confrontare il cambiamento del segnale, la precisione e le differenze nei tempi di reazione tra CueD e CueE (ipotesi 1 e 2).
I test post hoc hanno comportato test t separati per ogni ROI all’interno di ogni rete. L’analisi delle ROI è stata corretta con Bonferroni se il test omnibus della rete non era significativo. Presentiamo p-valori non corretti e un commento che indica se questo p-valore sarebbe sopravvissuto alla correzione Bonferroni per tutti i confronti multipli. SPSS 24 è stato utilizzato per tutte le analisi statistiche.
Risultati
Performance
L’accuratezza per gli stimoli facili (“StimE”) era 98% ± 1,2% SEM e per gli stimoli difficili (“StimD”) 85% ± 2,6%. Il tempo di reazione per StimE è stato di 682 ± 20 ms e per StimD di 1.138 ± 27 ms. Entrambe le condizioni mostrano tassi di precisione sufficienti per essere sicuri che il compito è stato eseguito come da istruzioni di tutti i partecipanti. Come ipotizzato, i partecipanti hanno risposto in modo meno accurato (T = -4,3, p < 0,001) e più lento (T = 17,8, p < 0,001) per StimD che per StimE (Figura 3), indicando che il contrasto tra gli stimoli facili e difficili ha avuto successo.
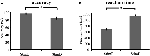
Figura 3. Risultati delle prestazioni. (A) Precisione per entrambe le categorie di stimoli, (B) tempo di reazione per entrambe le categorie di stimoli. Le barre di errore rappresentano l’errore standard della media (SEM). *p ≤ 0.001. Abbreviazioni: StimE, un segnale che indica uno stimolo facile, seguito da uno stimolo facile; StimD, un segnale che indica uno stimolo difficile, seguito da uno stimolo difficile.
RM funzionale
Descrittivi
La rete TIA consisteva di 20 ROI, di cui 10 erano basati su massimi locali per CueE, cinque erano basati su massimi locali per CueD, e cinque contenevano sia un massimo CueE che un massimo CueD (Tabella 1). Di queste 20 ROI, 19 hanno mostrato un’attività significativa rispetto alla linea di base per CueE, 18 per CueD (Tabella 1). La variazione media del segnale in TIA rispetto alla linea di base per CueE era 0.12 ± 0.02 (t = 6.11, p < 0.001) e per CueD 0.12 ± 0.02 (t = 7.61, p < 0.001).
La rete TID consisteva di 11 ROI, di cui tre erano basati su massimi locali per CueE, sei erano basati su massimi locali per CueD, e due conteneva sia un CueE e un massimo CueD (Tabella 1). Di queste 11 ROI, quattro hanno mostrato un’attività significativa rispetto alla linea di base per CueE, 10 per CueD (Tabella 1). La variazione media del segnale in TID rispetto alla linea di base per CueE era -0.07 ± 0.02 (t = 2.68, p < 0.01), e per CueD -0.12 ± 0.02 (t = 5.37, p < 0.001; Tabella 3).
Tuning alla difficoltà attesa
L’aumento del segnale in TIA non era significativamente più forte per CueD rispetto a CueE (t = -0,24, p = 0,41) indicando che il livello di attivazione TIA non è sintonizzato alla difficoltà attesa (Figura 4, Tabella 3). L’analisi ROI post hoc ha mostrato nessuna delle 20 ROI all’interno di TIA con un aumento significativo del segnale per CueD rispetto a CueE dopo aver applicato la correzione di Bonferroni (Tabella 4, Figura 5).
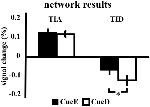
Figura 4. Panoramica dei risultati della rete. Le barre di errore rappresentano il SEM. *p ≤ 0,05 per cue difficile vs. cue facile. Abbreviazioni: TIA, rete di attivazione indotta dal compito; TID, rete di disattivazione indotta dal compito; CueE, un cue che indica uno stimolo facile, non seguito da uno stimolo; CueD, un cue che indica uno stimolo difficile, non seguito da uno stimolo.
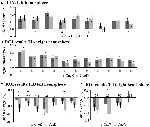
Figura 5. Panoramica delle singole risposte ROI all’interno della rete di attivazione indotta dal compito, emisfero sinistro (A) e destro (B), e disattivazione indotta dal compito, emisfero sinistro (C), e destro (D). Le barre di errore rappresentano SEM. *p ≤ 0.05 per CueD vs CueE, vedi Figura 2 per la posizione delle ROI, vedi Tabella 1 per i nomi, le abbreviazioni e le coordinate MNI delle ROI.
La diminuzione del segnale in TID era significativamente più forte per CueD rispetto a CueE (T = -2.48, p = 0.01) indicando che il livello di TID è sintonizzato sulla difficoltà prevista (Tabella 3, Figura 4). Post hoc analisi ROI ha mostrato quattro su 11 ROI di TID con una diminuzione significativa del segnale per CueD rispetto a CueE, vale a dire LMPFG (T = -1.83, p = 0.04), LSPG (T = -2.32, p = 0.02), LSTG (T = -2.69, p < 0.01), e RCALC (T = -2.90, p < 0.01). Questi risultati indicano che la sintonizzazione sulla difficoltà prevista è più forte nelle ROI frontali, temporali e visive di sinistra (Tabella 4, Figura 5).
Discussione
In questo studio, abbiamo esaminato se e come la vigilanza fasica è sintonizzata sulla difficoltà prevista di una prossima sfida cognitiva. L’allerta fasica si rifletteva in regioni cerebrali attivate e disattivate. La rete attivata comprendeva regioni della rete esecutiva centrale. La rete disattivata includeva regioni della DMN, così come cortecce visive. Il livello di disattivazione era proporzionale alla difficoltà prevista dello stimolo imminente, mentre il livello di attivazione non lo faceva. Questi risultati suggeriscono che la modulazione della vigilanza fasica si riflette prevalentemente nei processi di soppressione graduata che sono irrilevanti per il compito corrente (per esempio processi cardio-vagali, uditivi e visivi). Probabilmente, questo si è verificato perché questi processi potrebbero interferire con le prossime sfide cognitive.
Studi di imaging precedenti di allerta fasica utilizzato un livello di difficoltà, presentato solo regioni cerebrali attivate (Shulman et al., 1999; Sturm e Willmes, 2001; Thiel et al., 2004; Fan et al., 2005; Périn et al., 2010; Yanaka et al., 2010), o focalizzato esclusivamente sull’attività nella corteccia visiva (Bartolucci e Smith, 2011). Questi studi hanno identificato una rete fronto-parietale-talamica per lo più laterale destra, a volte combinata con regioni corticali motorie e visive, che è stata attivata da un cue. Ci sono differenze sostanziali nelle reti attivate tra gli studi. Alcune delle differenze tra le reti negli studi precedenti possono essere spiegate dal compito che seguiva l’indicazione. Per esempio, Thiel et al. (2004) hanno identificato solo l’attivazione nelle regioni corticali visive usando un compito di percezione visiva, mentre Fan et al. (2005) e Yanaka et al. (2010) hanno identificato l’attivazione talamica e motoria con un compito di risposta motoria. Sebbene Bartolucci e Smith (2011) presentino un elegante disegno di compito con quattro livelli di difficoltà di un compito di discriminazione dell’orientamento, hanno presentato solo l’attivazione nella corteccia visiva. Pertanto, non è chiaro come altre regioni del cervello abbiano risposto a questo compito. La rete di attivazione indotta dal compito, identificata nello studio attuale è più simile alla rete trovata da Shulman et al. (1999), che ha utilizzato un tipo simile di compito di elaborazione visiva.
Non è chiaro se la vigilanza fasica è una risposta bottom-up o top-down a un cue non informativo (Thiel et al., 2004; Hackley, 2009; Périn et al., 2010; Bartolucci e Smith, 2011; Chica et al., 2016). L’allerta fasica è stata considerata da alcuni come una risposta bottom-up (Sturm et al., 1999; Hackley, 2009), da altri come top-down (Bartolucci e Smith, 2011), e da altri ancora come una combinazione (Thiel et al., 2004; Périn et al., 2010). Noi sosteniamo che sia più adatto etichettare la risposta del cervello a una stecca come una combinazione di elaborazione bottom-up e top-down perché i partecipanti rispondono sia a una stecca esterna che a un’istruzione associata a questa stecca. Tuttavia, i nostri risultati principali riguardano la differenza di risposta a due spunti simili che indicano un diverso tipo di stimolo del compito. Pertanto, sosteniamo che la differenza risultante tra lo spunto che indica un compito difficile e lo spunto che indica un compito facile può rappresentare un livello di controllo top-down relativo all’interpretazione dello spunto e dell’istruzione associata.
La rete di disattivazione indotta dal compito includeva regioni cerebrali del DMN, cioè il giro prefrontale mediale, i giro temporali superiori e i giroscopi angolari (Shulman et al., 1999; Raichle et al., 2001; Raichle, 2015). È comunemente ipotizzato che la disattivazione del DMN aiuti le prestazioni dei compiti riducendo i processi interni che interferiscono con le sfide cognitive (Raichle et al., 2001; Buckner et al., 2008; Raichle, 2015). Questo punto di vista è supportato da studi che mostrano che il livello di disattivazione DMN scala con la difficoltà di un compito durante l’esecuzione del compito (McKiernan et al., 2003; Singh e Fawcett, 2008). Questi studi hanno esaminato la disattivazione durante l’esecuzione del compito. I nostri risultati suggeriscono che questo scaling può avvenire già durante la fase di anticipazione del compito. Weissman et al. (2006) hanno esaminato la variabilità dei tempi di reazione individuali per identificare i vuoti di attenzione. I vuoti di attenzione potrebbero essere associati a una ridotta disattivazione della DMN. Mentre (Weissman et al., 2006) hanno esaminato la variazione naturale nel livello di attenzione, i nostri risultati indicano che la disattivazione in diverse regioni DMN può anche essere sintonizzata in modo top-down prima che lo stimolo del compito sia presentato.
Gli effetti di sintonizzazione più profondi sono stati trovati nella prefrontale mediale sinistra, nelle regioni temporali e visive. Di seguito discutiamo le possibili implicazioni di questi effetti per queste regioni in relazione alla loro funzione proposta.
L’attività della corteccia prefrontale mediale è stata precedentemente associata al mind-wandering (Bertossi et al., 2017), al recupero della memoria (Euston et al., 2012) e al controllo cardiovagale (Wong et al., 2007). Questa disattivazione prefrontale mediale suggerisce che una qualsiasi di queste funzioni è già soppressa in previsione di una sfida cognitiva.
La sintonizzazione della disattivazione alla difficoltà prevista nelle regioni visive e temporali può essere legata alla soppressione dell’input sensoriale visivo e uditivo irrilevante. La sintonizzazione nelle regioni temporali bilaterali può essere specificamente legata alla soppressione del rumore generato dallo scanner MRI. È ragionevole aspettarsi che il livello del suono sia simile tra le condizioni. Il fatto che il livello di disattivazione sia più forte per gli spunti difficili suggerisce che l’elaborazione del suono ambientale è soppressa più fortemente se ci si aspetta un compito difficile. La disattivazione nelle cortecce visive è meno comunemente riportata rispetto alla disattivazione nelle regioni temporali. Tuttavia, Smith et al. (2000) hanno precedentemente riportato un’associazione tra la disattivazione diffusa nella corteccia visiva e l’attenzione a una parte specifica di un’immagine. Giesbrecht et al. (2006) hanno anche riportato una modulazione dell’attivazione visiva associata all’attenzione occulta a oggetti vicini al centro del campo visivo rispetto a oggetti nel campo visivo periferico. Questi risultati indicano che l’attivazione nelle cortecce visive può essere modulata dall’attenzione occulta a regioni foveali o periferiche. Il nostro studio aggiunge una nuova dimensione a questi risultati, in quanto suggerisce che l’attivazione nelle cortecce visive non è solo modulata dalla posizione dell’attenzione visiva nascosta, ma anche dalla difficoltà prevista di una sfida visiva; e poiché gli spunti erano identici per posizione e dimensione questo processo sembra regolato in modo top-down.
Abbiamo anche identificato un insieme di regioni cerebrali che hanno mostrato un aumento di attivazione in previsione di una sfida cognitiva. Questa rete ha mostrato somiglianza con la rete esecutiva centrale che è stata precedentemente associata all’esecuzione di compiti di memoria di lavoro (Lawrence et al., 2003). Tuttavia, l’attivazione in questa rete non era sintonizzata sulla difficoltà prevista del compito. Ciò suggerisce che queste regioni rappresentano processi che sono simili per la condizione difficile e facile. È possibile che l’attività in questa rete sia associata alla valutazione dell’indizio, o al recupero e al mantenimento del contesto del compito e delle istruzioni.
È necessario prendere in considerazione alcune limitazioni che possono influenzare l’interpretazione dei nostri risultati. In primo luogo, non abbiamo incluso prove con stimoli che non erano preceduti da un cue, quindi non è possibile esaminare l’effetto del cue sulla performance cognitiva. A causa della limitazione di tempo, non è stato possibile ripetere il nostro compito usando stimoli identici ma senza spunti.
In secondo luogo, abbiamo usato un punto esclamativo come parte dello spunto che indica una sfida cognitiva difficile perché questo simbolo è tipicamente usato se c’è bisogno di una maggiore attenzione. È possibile che il punto esclamativo stesso possa aver giocato un ruolo nei diversi modelli di attivazione per la condizione facile e difficile, a causa del suo significato intrinseco. Questo, tuttavia, non influisce sull’interpretazione principale dei nostri risultati, tranne che i nostri risultati principali possono essere classificati come una risposta bottom-up invece di una risposta top-down. Infine, il nostro disegno sperimentale non ci permette di esaminare se l’attività relativa all’allerta fasica può essere generalizzata ad altri domini, o se è dominio-specifica, poiché includeva solo una sfida cognitiva visuo-percettiva.
Per concludere, in questo studio abbiamo dimostrato che la sintonizzazione dell’allerta fasica è rappresentata dal livello di disattivazione in diverse regioni. Questo effetto è più forte nella corteccia mediale prefrontale, visiva e temporale che può riflettere una soppressione del controllo cardiovagale, l’elaborazione visiva nel campo visivo periferico e la soppressione del rumore dello scanner MRI. Questi risultati suggeriscono che la performance cognitiva è facilitata da uno stato del cervello che è strettamente accoppiato alle aspettative sulla difficoltà di una sfida cognitiva imminente.
Data Availability
I dati grezzi sono stati generati all’ospedale Elisabeth-Tweesteden. I dati derivati che supportano i risultati di questo studio sono disponibili dall’autore corrispondente su richiesta ragionevole.
Dichiarazione etica
Questo studio è stato condotto in conformità con le raccomandazioni del Dutch social support act, comitato etico medico Brabant. Tutti i soggetti hanno dato il consenso informato scritto in conformità con la Dichiarazione di Helsinki. Il protocollo è stato approvato dal comitato etico medico Brabant.
Contributi degli autori
MD e JJ hanno scritto il manoscritto principale e preparato le figure. MD e IS hanno eseguito gli esperimenti. G-JR, NR e JJ hanno supervisionato congiuntamente il lavoro. Tutti gli autori hanno rivisto il manoscritto.
Finanziamento
Questo studio è stato finanziato da ZonMW, un’organizzazione nazionale olandese (Netherlands Organization for Health Research and Development, ZONMW; numero di progetto: 842003004), titolo del progetto: Implementazione clinica di tecniche avanzate di risonanza magnetica per la localizzazione e il monitoraggio delle funzioni sensorimotorie e cognitive in pazienti con tumori cerebrali.
Dichiarazione di conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Riconoscimenti
Si ringrazia il radiografo William Pigmans e Maikel Brands per il loro contributo a questo studio.
Abbreviazioni
DMN, default mode network; M, maschio; F, femmina; GLM, modello lineare generale; SPM, mappatura statistica parametrica; CueE, un segnale che indica uno stimolo facile, non seguito da uno stimolo; CueD, un segnale che indica uno stimolo difficile, non seguito da uno stimolo; StimE, un cue che indica uno stimolo facile, seguito da uno stimolo facile; StimD, un cue che indica uno stimolo difficile, seguito da uno stimolo difficile; MRI, risonanza magnetica; ROI, regione di interesse; GDL, GNU data language; TIA, task induced activation network; TID, task induced deactivation network; SEM, errore standard della media.
Note
- ^ https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/project-detail/topzorg/clinical-implementation-of-advanced-mri-techniques-for-localization-and-monitoring-of-sensorimotor-a/verslagen/
- ^ http://www.fil.ion.ucl.ac.uk/spm/software/spm12/
- ^ https://github.com/gnudatalanguage/gdl
Bartolucci, M., e Smith, A. T. (2011). Modulazione attenzionale nella corteccia visiva è modificato durante l’apprendimento percettivo. Neuropsychologia 49, 3898-3907. doi: 10.1016/j.neuropsychologia.2011.10.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bertossi, E., Peccenini, L., Solmi, A., Avenanti, A., and Ciaramelli, E. (2017). La stimolazione transcranica a corrente diretta della corteccia prefrontale mediale smorza il mind-wandering negli uomini. Sci. Rep. 7:16962. doi: 10.1038/s41598-017-17267-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Buckner, R. L., Andrews-Hanna, J. R., e Schacter, D. L. (2008). La rete di default del cervello: anatomia, funzione e rilevanza per la malattia. Ann. N Y Acad. Sci. 1124, 1-38. doi: 10.1196/annals.1440.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Buracas, G. T., e Boynton, G. M. (2002). Progettazione efficiente di eventi correlati esperimenti fMRI utilizzando M-sequenze. Neuroimage 16, 801-813. doi: 10.1006/nimg.2002.1116
PubMed Abstract | CrossRef Full Text | Google Scholar
Čeko, M., Gracely, J. L., Fitzcharles, M. A., Seminowicz, D. A., Schweinhardt, P., e Bushnell, M. C. (2015). È una rete di modalità predefinita reattivo richiesto per prestazioni di successo compito di memoria di lavoro? J. Neurosci. 35, 11595-11605. doi: 10.1523/JNEUROSCI.0264-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Chica, A. B., Bayle, D. J., Botta, F., Bartolomeo, P., e Paz-Alonso, P. M. (2016). Interazioni tra allerta fasica e coscienza nella rete fronto-striatale. Sci. Rep. 6:13. doi: 10.1038/srep31868
PubMed Abstract | CrossRef Full Text | Google Scholar
Desmond, J. E., e Glover, G. H. (2002). Stimare la dimensione del campione in studi di neuroimaging MRI funzionale (fMRI): analisi di potenza statistica. J. Neurosci. Methods 118, 115-128. doi: 10.1016/s0165-0270(02)00121-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Euston, D. R., Gruber, A. J., e McNaughton, B. L. (2012). Il ruolo della corteccia prefrontale mediale nella memoria e nel processo decisionale. Neuron 76, 1057-1070. doi: 10.1016/j.neuron.2012.12.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Fossella, J., Flombaum, J. I., e Posner, M. I. (2005). L’attivazione delle reti attenzionali. Neuroimage 26, 471-479. doi: 10.1016/j.neuroimage.2005.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Sommer, T., Raz, A., e Posner, M. I. (2002). Testare l’efficienza e l’indipendenza delle reti attenzionali. J. Cogn. Neurosci. 14, 340-347. doi: 10.1162/089892902317361886
PubMed Abstract | CrossRef Full Text | Google Scholar
Giesbrecht, B., Weissman, D. H., Woldorff, M. G., e Mangun, G. R. (2006). Pre-target attività nella corteccia visiva predice prestazioni comportamentali su compiti di attenzione spaziale e caratteristica. Brain Res. 1080, 63-72. doi: 10.1016/j.brainres.2005.09.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Hackley, S. A. (2009). L’accelerazione della reazione volontaria da un segnale di avvertimento. Psicofisiologia 46, 225-233. doi: 10.1111/j.1469-8986.2008.00716.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Härmä, M., Partinen, M., Repo, R., Sorsa, M., and Siivonen, P. (2008). Effetti dei sistemi di guardia 6/6 e 4/8 sulla sonnolenza degli ufficiali di ponte. Chronobiol. Int. 25, 413-423. doi: 10.1080/07420520802106769
PubMed Abstract | CrossRef Full Text | Google Scholar
Hedden, T., Van Dijk, K. R., Shire, E. H., Sperling, R. A., Johnson, K. A., e Buckner, R. L. (2012). L’incapacità di modulare il controllo attenzionale nell’invecchiamento avanzato legato alla patologia della materia bianca. Cereb. Cortex 22, 1038-1051. doi: 10.1093/cercor/bhr172
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., Ramsey, N. F., de Zwart, J. A., van Gelderen, P., and Duyn, J. H. (2007). studio fMRI di sforzo e di elaborazione delle informazioni in un compito di memoria di lavoro. Hum. Brain Mapp. 27, 431-440. doi: 10.1002/hbm.20297
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., and Rutten, G. J. (2017). “Una proposta per un sistema che facilita la replica quantitativa degli studi fMRI”, in Proceedings of the Human Brain Mapping Conference 2017 June 25-29, Vancouver, Canada. Disponibile online a: https://archive.aievolution.com/2017/hbm1701/index.cfm?do=abs.viewAbs&abs=4047.
Google Scholar
Kriegeskorte, N., Simmons, W. K., Bellgowan, P. S., e Baker, C. I. (2009). Analisi circolare in neuroscienze dei sistemi: i pericoli di double dipping. Nat. Neurosci. 12, 535-540. doi: 10.1038/nn.2303
PubMed Abstract | CrossRef Full Text | Google Scholar
Kusnir, F., Chica, A. B., Mitsumasu, M. A., e Bartolomeo, P. (2011). L’allerta uditiva fasica migliora la percezione visiva cosciente. Consapevole. Cogn. 20, 1201-1210. doi: 10.1016/j.concog.2011.01.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Lawrence, M. A., Ross, T. J., Hoffmann, H. G., e Stein, E. S. (2003). Reti neurali multiple mediano l’attenzione sostenuta. J. Cogn. Neurosci. 15, 1028-1038. doi: 10.1162/089892903770007416
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, G., Sobering, G., Duyn, J., e Moonen, C. T. (1993). Una tecnica di risonanza magnetica funzionale che combina principi di eco-shifting con un treno di osservazioni (PRESTO). Magn. Reson. Med. 30, 764-768. doi: 10.1002/mrm.1910300617
PubMed Abstract | CrossRef Full Text | Google Scholar
Macleod, J. W., Lawrence, M. A., McConnell, M. M., Eskes, G. A., Klein, R. M., and Shore, D. I. (2010). Valutazione dell’ANT: considerazioni psicometriche e teoriche del test della rete di attenzione. Neuropsicologia 24, 637-651. doi: 10.1037/a0019803
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., D’Angelo, B. R. D., Kaufman, J. N., e Binder, J. R. (2006). Interrompere il “flusso di coscienza”: un’indagine fMRI. Neuroimage 29, 1185-1191. doi: 10.1016/j.neuroimage.2005.09.030
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., Kaufman, J. N., Kucera-Thompson, J. K., e Binder, J. R. (2003). Una manipolazione parametrica dei fattori che influenzano la disattivazione indotta dal compito nel neuroimaging funzionale. J. Cogn. Neurosci. 15, 394-408. doi: 10.1162/089892903321593117
PubMed Abstract | CrossRef Full Text | Google Scholar
Nebes, R. D., e Brady, C. B. (1993). Allerta fasica e tonica nella malattia di Alzheimer. Cortex 29, 77-90. doi: 10.1016/s0010-9452(13)80213-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Neggers, S. F., Hermans, E. J., and Ramsey, N. F. (2008). Maggiore sensibilità con veloce tridimensionale sangue-ossigeno-livello dipendente MRI funzionale: confronto di SENSE-PRESTO e 2D-EPI a 3 T. NMR Biomed. 21, 663-676. doi: 10.1002/nbm.1235
PubMed Abstract | CrossRef Full Text | Google Scholar
Périn, B., Godefroy, O., Fall, S., e de Marco, G. (2010). Allerta in giovani soggetti sani: uno studio fMRI dell’interattività delle regioni cerebrali potenziata da un segnale di allarme. Cervello Cogn. 72, 271-281. doi: 10.1016/j.bandc.2009.09.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pyka, M., Beckmann, C. F., Schöning, S., Hauke, S., Heider, D., Kugel, H., et al. Impatto del carico della memoria di lavoro sul modello di stato a riposo FMRI nelle successive fasi di riposo. PLoS One 4:e7198. doi: 10.1371/journal.pone.0007198
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E. (2015). La rete di modalità predefinita del cervello. Annu. Rev. Neurosci. 38, 433-447. doi: 10.1146/annurev-neuro-071013-014030
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E., MacLeod, J. W., Snyder, A. Z., Powers, W. J., Gusnard, D. A., e Shulman, G. L. (2001). Una modalità predefinita di funzione del cervello. Proc. Natl. Acad. Sci. U S A 98, 676-682. doi: 10.1073/pnas.98.2.676
PubMed Abstract | CrossRef Full Text | Google Scholar
Shulman, G. L., Ollinger, J. M., Akbudak, E., Conturo, T. E., Snyder, A. Z., Petersen, S. E., et al. Aree coinvolte nella codifica e nell’applicazione delle aspettative direzionali agli oggetti in movimento. J. Neurosci. 19, 9480-9496. doi: 10.1523/jneurosci.19-21-09480.1999
PubMed Abstract | CrossRef Full Text | Google Scholar
Singh, K. D., e Fawcett, I. P. (2008). Disattivazione transitoria e linearmente graduata della rete umana di default-mode da un compito di rilevamento visivo. Neuroimage 41, 100-112. doi: 10.1016/j.neuroimage.2008.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, A. T., Singh, K. D., e Greenlee, M. W. (2000). Soppressione attenzionale dell’attività nella corteccia visiva umana. Neuroreport 11, 271-277. doi: 10.1097/00001756-200002070-00010
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., de Simone, A., Krause, B. J., Specht, K., Hessemann, V., Radermacher, I., et al. Anatomia funzionale della vigilanza intrinseca: evidenza di una rete froto-parietale-talamica-brainstemica nell’emisfero destro. Neuropsicologia 37, 797-805. doi: 10.1016/s0028-3932(98)00141-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., and Willmes, K. (2001). Sulla neuroanatomia funzionale della vigilanza intrinseca e fasica. Neuroimage 14, S76-S84. doi: 10.1006/nimg.2001.0839
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, C. M., Zilles, K., e Fink, G. R. (2004). Correlati cerebrali di allerta, orientamento e riorientamento dell’attenzione visuospaziale: uno studio event-related fMRI. Neuroimage 21, 318-328. doi: 10.1016/j.neuroimage.2003.08.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. Etichettatura anatomica automatizzata delle attivazioni in SPM usando una parcellizzazione anatomica macroscopica del cervello MNI MRI a soggetto singolo. Neuroimage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
van Gelderen, P., Ramsey, N. F., Liu, G., Duyn, J. H., Frank, J. A., Weinberger, D. R., et al. (1995). Risonanza magnetica funzionale tridimensionale del cervello umano su uno scanner clinico 1.5-T. Proc. Natl. Acad. Sci. U S A 92, 6906-6910. doi: 10.1073/pnas.92.15.6906
PubMed Abstract | CrossRef Full Text | Google Scholar
Weinbach, N., e Henik, A. (2011). Allerta fasica può modulare il controllo esecutivo migliorando l’elaborazione globale degli stimoli visivi. Cognition 121, 454-458. doi: 10.1016/j.cognition.2011.08.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Weissman, D. H., Roberts, K. C., Visscher, K. M., e Woldorff, M. G. (2006). Le basi neurali dei vuoti momentanei di attenzione. Nat. Neurosci. 9, 971-978. doi: 10.1038/nn1727
PubMed Abstract | CrossRef Full Text | Google Scholar
Wong, S. W., Massé, N., Kimmerly, D. S., Menon, R. S., e Shoemaker, J. K. (2007). Corteccia prefrontale mediale ventrale e controllo cardiovagale negli esseri umani coscienti. Neuroimage 35, 698-708. doi: 10.1016/j.neuroimage.2006.12.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanaka, H. T., Saito, D. N., Uchiyama, Y., e Sadato, N. (2010). Substrati neurali di allerta fasica: uno studio di risonanza magnetica funzionale. Neurosci. Res. 68, 51-58. doi: 10.1016/j.neures.2010.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar