Introduction
Des recherches antérieures montrent que les gens peuvent utiliser un indice pour se préparer mentalement à un défi cognitif. Si les participants ont pour instruction de se préparer mentalement au moment où un indice est présenté, cela a été défini comme une vigilance phasique . La capacité d’influencer notre niveau de vigilance pourrait être importante, notamment si la vigilance a un coût. Si la demande de vigilance est trop élevée, cela peut potentiellement conduire à la fatigue (Härmä et al., 2008) ou à des problèmes liés au stress. Dans cette étude, nous voulons examiner si et comment des adultes en bonne santé accordent leur niveau de vigilance à la difficulté attendue d’une tâche cognitive à venir.
Si un indice est présenté juste avant le stimulus d’une tâche, les gens sont généralement capables de répondre plus rapidement dans des tâches de réponse motrice simple (Fan et al., 2002 ; Macleod et al., 2010 ; Weinbach et Henik, 2011) et de percevoir plus précisément des stimuli visuels dégradés (Kusnir et al., 2011). Des études d’imagerie ont montré que la vigilance phasique est associée à une activation accrue des régions frontales, pariétales, thalamiques (Shulman et al., 1999 ; Fan et al., 2005 ; Yanaka et al., 2010), temporo-occipitales (Thiel et al., 2004) et visuelles du cerveau (Bartolucci et Smith, 2011). Ces études d’imagerie ont fourni des informations précieuses sur la représentation de la vigilance phasique dans le cerveau. Cependant, la vigilance phasique a généralement été étudiée comme un phénomène de type marche/arrêt ou l’analyse a été limitée au cortex visuel. Par conséquent, on ne sait pas si la vigilance reflète également la difficulté attendue du défi cognitif dans les réseaux cérébraux entiers.
En outre, des études antérieures ont indiqué que la désactivation des régions cérébrales qui font partie du réseau du mode par défaut (DMN) peut faciliter l’exécution des tâches cognitives. Premièrement, des études sur l’exécution de tâches montrent qu’un niveau croissant de difficulté de la tâche est associé à une désactivation croissante (McKiernan et al., 2003, 2006 ; Jansma et al., 2007 ; Singh et Fawcett, 2008 ; Pyka et al., 2009 ; Hedden et al., 2012 ; Čeko et al., 2015). Ensuite, Jansma et al. (2007) ont montré que la partie préfrontale médiane du DMN s’accorde uniquement à la difficulté de la tâche, que le participant pouvait anticiper, mais n’était pas affectée par la difficulté réelle de chaque stimulus, que le participant ne pouvait pas anticiper. Enfin, Weissman et al. (2006) ont constaté que la désactivation dans le DMN juste avant le stimulus était plus faible si les sujets répondaient relativement lentement. Peut-être que ces sujets répondaient plus lentement parce qu’ils étaient temporairement moins alertes.
Pour notre étude, nous avons conçu une tâche de perception visuelle guidée avec une condition facile et difficile. Les indices fournissaient des informations sur la difficulté du stimulus à venir, mais ne fournissaient aucune information susceptible de faciliter la tâche elle-même. Dans la moitié des essais, l’indice n’était pas suivi d’un stimulus. Seuls ces essais ont fait l’objet d’une analyse de l’activité cérébrale afin de pouvoir isoler complètement l’activation associée à l’indice de l’activation associée à l’exécution de la tâche. Nous émettons l’hypothèse que les participants accordent leur activité à la difficulté attendue de la tâche.
Matériels et méthodes
Participants
Les participants ont été recrutés via une publicité en ligne. Les participants étaient exclus s’ils rapportaient des antécédents de troubles neurologiques ou psychiatriques importants, ou des contre-indications à l’imagerie par résonance magnétique (IRM) (objets métalliques dans ou autour du corps, claustrophobie ou grossesse). Cette étude a été réalisée conformément aux recommandations de la loi sur la recherche médicale impliquant des sujets humains (WMO), Comité d’éthique de la recherche médicale de Brabant. Le protocole a été approuvé par le Comité d’éthique de la recherche médicale (numéro de protocole : NL51147.028.14). Tous les sujets ont donné leur consentement éclairé écrit conformément à la Déclaration d’Helsinki.
Vingt-deux volontaires droitiers en bonne santé ont participé à l’étude. Les données de deux participants ont été exclues en raison d’artefacts du scanner. Les résultats sont rapportés pour les 20 participants restants.
Conception de la tâche
Nous avons conçu une tâche (avec une conception liée aux événements) qui nous a permis d’examiner les effets d’anticipation liés à la difficulté attendue d’une tâche, sans confondre les effets de l’exécution de la tâche.
Les stimuli de la tâche consistaient en neuf flèches dans une disposition trois par trois sur un écran noir (figure 1). Un « stimulus facile » contenait huit flèches dans la bonne direction et une flèche dans la direction opposée. Un « stimulus difficile » contenait cinq flèches dans la bonne direction et quatre flèches dans la direction opposée (figure 1). Les participants avaient pour instruction d’appuyer sur un bouton avec la main correspondant à la direction de la majorité des flèches. Les stimuli faciles et difficiles étaient présentés dans un ordre aléatoire. Les stimuli de base consistaient en un écran noir fixe avec le texte suivant « vous avez une pause de 30 s » en néerlandais et en lettres blanches. Les stimuli ont été présentés par le logiciel « présentation ».
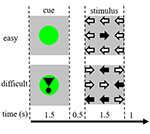
Figure 1. Représentation des stimuli visuels. Chaque essai durait 4,5 s. Dans la moitié des essais, l’indice n’était pas suivi d’un stimulus. Ces essais ont été utilisés pour l’analyse par imagerie par résonance magnétique fonctionnelle (IRMf).
Chaque essai commençait par un indice indiquant la difficulté du stimulus présenté par la suite. Un point vert indiquait un « stimulus facile », un point vert avec un point d’exclamation indiquait un « stimulus difficile » (figure 1).
Dans la moitié des essais, l’indice n’était pas suivi d’un stimulus, dans l’autre moitié, le stimulus était présenté 500 ms après la disparition de l’indice. On a ainsi obtenu quatre conditions : (1) un repère pour un stimulus facile, non suivi d’un stimulus (« CueE ») ; (2) un repère pour un stimulus difficile, non suivi d’un stimulus (« CueD ») ; (3) un repère pour un stimulus facile, suivi d’un stimulus facile (« StimE ») ; et (4) un repère pour un stimulus difficile, suivi d’un stimulus difficile (« StimD »). Toutes les conditions étaient contrastées par rapport à la ligne de base. Les résultats de l’IRM fonctionnelle (IRMf) étaient basés sur CueE et CueD. Les résultats de performance étaient basés sur StimE et StimD. Les CueE et CueD ont été présentés dans un ordre pseudo-aléatoire en utilisant des séquences M pour maximiser l’indépendance des régresseurs du modèle linéaire général (GLM) entre les conditions et optimiser l’efficacité de la conception (Buracas et Boynton, 2002). Les participants ne pouvaient pas prédire si un indice serait suivi d’un stimulus ou non.
La durée de chaque essai était de 4 500 ms. Les indices étaient présentés à t = 0 pendant 1 500 ms et les stimuli étaient présentés à t = 2 000, également pendant 1 500 ms (figure 1). La tâche a été réalisée en deux séries de 68 essais. La ligne de base consistait en trois périodes de repos de 30 secondes, avant, après et entre les deux séries. La durée totale de la tâche était de 11,7 minutes. Il s’agissait de la deuxième tâche de la session et elle a commencé après que les participants aient été couchés environ 10 min dans le scanner.
Les participants ont reçu l’instruction de se préparer à un stimulus facile ou difficile en fonction des informations de l’indice (figure 1) et d’indiquer aussi précisément et rapidement que possible la direction de la majorité des flèches du stimulus. Les participants se sont entraînés à la tâche en dehors du scanner en suivant un protocole d’entraînement standard de 3 minutes. Ce protocole était répété si les performances étaient insuffisantes (moins de 70% de précision pour les stimuli difficiles).
Un miroir fixé à la bobine de tête permettait aux participants de voir un écran de projection transparent positionné derrière la tête. Un vidéoprojecteur situé dans la salle du scanner projetait les stimuli de la tâche sur l’écran. Deux boîtes à boutons pneumatiques à pression d’air étaient utilisées pour enregistrer les réponses. Les participants utilisaient le pouce ou l’index gauche pour répondre « gauche » et le droit pour répondre « droite ».
Acquisition d’images
Les scanners ont été réalisés sur un scanner 3T Philips Achieva (Philips Medical Systems, Best, Pays-Bas) en utilisant une bobine de tête SENSE à 32 canaux. Une image structurelle 3D pondérée en T1 a été acquise à des fins d’enregistrement anatomique . Les images IRMf ont été obtenues en utilisant une séquence d’impulsions 3D PRESTO . Six scans factices ont été acquis puis rejetés par le scanner.
Prétraitement des images
Les données d’IRMf ont été prétraitées en utilisant la cartographie paramétrique statistique (SPM12 ; Wellcome Trust Centre for Neuroimaging, University College London, Londres, UK2). Les scans d’une session ont été réalignés sur le premier scan pour corriger le mouvement du sujet en utilisant une approche des moindres carrés, une transformation spatiale à six paramètres (corps rigide) et une estimation B-spline de 2e degré. Les scans ont été co-enregistrés sur le T1 en utilisant un modèle de corps rigide. Les paramètres ont été estimés par la fonction d’information mutuelle normalisée. Les images ont été redécoupées par une B-spline de 4ème degré. Le T1 a été normalisé spatialement dans l’espace MNI standard en utilisant une très légère régularisation du biais (0,0001) et un B-spline du 4ème degré. Les paramètres résultants ont été appliqués à tous les scans fonctionnels afin de minimiser les différences anatomiques et ainsi permettre une analyse de groupe. Enfin, tous les scans ont été lissés spatialement avec un filtre gaussien 3D (pleine largeur à demi-maximum : 8 mm) pour minimiser davantage l’effet des différences anatomiques fonctionnelles.
Analyse IRMf individuelle
Une analyse de régression GLM liée à l’événement a été effectuée pour chaque voxel afin de générer des cartes d’activation individuelles en utilisant une approche univariée de masse avec un modèle d’autocorrélation global approximatif AR(1), et un filtre passe-haut (coupure de 128 s). La ligne de base n’a pas été explicitement modélisée. La fonction de base était une HRF canonique sans dérivés. Un seuil de masquage de 0,8 a été utilisé. Des régresseurs distincts ont été utilisés pour chaque condition (CueE, 17 points temporels ; CueD, 16 points temporels ; StimE, 17 points temporels ; StimD, 18 points temporels ; et un régresseur de nuisance pour les périodes de blanc dans la tâche liée à la séquence m, 68 points temporels). Aucun point temporel n’a été exclu de l’analyse. Les cartes bêta ont été transformées pour refléter le pourcentage réel de changement de signal dans chaque voxel. Nous présentons uniquement les résultats pour les régresseurs CueE et CueD, qui reflètent les changements de signal pour les signaux sans stimulus. Les cartes bêta et t statistiques ont été vérifiées visuellement pour détecter les artefacts majeurs.
Analyse IRMf de groupe
Une analyse IRMf de second niveau a été effectuée avec une régression linéaire à chaque voxel pour la visualisation et la sélection de la région d’intérêt (ROI). Une analyse ROI a été réalisée avec le langage de données GNU (GDL3), en utilisant les cartes de changement de signal en pourcentage des sujets individuels générées par l’analyse GLM. Les voxels au sein d’une ROI ou d’un réseau ont été moyennés pour calculer la différence de signal entre CueE, CueD et la ligne de base.
Sélection de la ROI
Des maxima et minima locaux supratentoriels ont été déterminés pour CueE et CueD par SPM avec un seuil non corrigé (p < 0,001 ; tableau 1). Des ROIs cubiques de taille et de forme prédéfinies ont été placés sur les maxima locaux pour le contraste CueE-baseline et CueD-baseline séparément dans une trame prédéfinie (Jansma et Rutten, 2017 ; tableau 2). Les ROIs étaient inclus dans l’analyse s’ils contenaient un maximum local significatif pour CueE ou CueD. En définissant les ROI sur les maxima locaux pour les deux conditions séparément, nous évitons tout biais en faveur du CueE ou du CueD. En outre, la forme et la taille prédéfinies des ROI dans une trame réduisent l’effet de circularité, car les limites de ces ROI ne sont pas affectées par le bruit (Kriegeskorte et al., 2009). De plus, cette méthode facilite la comparaison quantitative des résultats entre les conditions, et potentiellement entre différentes études, facilitant ainsi la reproductibilité quantitative des résultats d’IRMf. Le placement des ROIs sur les maxima locaux a optimisé la puissance. Cependant, on sait que l’emplacement du pic d’activité est affecté par le bruit, donc l’emplacement exact des ROIs peut toujours se reproduire pour chaque ROI. Cela n’affecte pas les résultats du réseau puisque tous les ROIs sont moyennés et l’emplacement exact, par conséquent, n’est pas aussi pertinent.
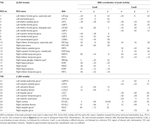
Tableau 1. Modèle d’activité.
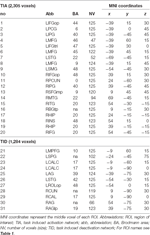
Tableau 2. Caractéristiques des régions d’intérêt (ROI).
Les ROI sur les régions présentant une augmentation de la variation du signal ont été combinées dans un réseau d’activation induite par la tâche (« TIA »). Les ROIs sur les régions avec une diminution du changement de signal ont été combinés dans un réseau de désactivation induite par la tâche (« TID » ; tableaux 1, 2). Dans la mesure du possible, les noms des ROI ont été déterminés à l’aide de l’atlas AAL (Tzourio-Mazoyer et al., 2002).
Le tableau 2 et la figure 2 donnent un aperçu de la taille et de l’emplacement de toutes les ROI. Comme la taille et les frontières des ROI sont prédéfinies, il est possible que l’activité moyenne dans la ROI ne soit pas significativement différente de la ligne de base, par exemple parce que le nombre de voxels activés dans la ROI est relativement faible. Bien que l’activité moyenne au niveau du réseau soit significativement différente de la ligne de base pour toutes les conditions (Tableau 3), ce n’est pas le cas pour huit des 31 ROIs individuels pour CueE et trois des 31 ROIs pour CueD (Tableau 4). Seuls les voxels qui contenaient un signal pour chaque participant ont été inclus dans l’analyse. La taille maximale d’une ROI est de 125 voxels, certaines ROI comprennent moins de 125 voxels car elles sont positionnées près du crâne.
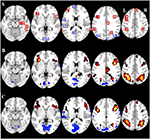
Figure 2. Aperçu de l’emplacement de la région d’intérêt (ROI) et des résultats de l’IRMf du cerveau entier. (A) ROIs pour l’activation induite par la tâche (rouge) et la désactivation induite par la tâche (bleu) note : ROI 22 n’est pas affiché car l’emplacement est en dehors des tranches choisies. Les coordonnées MNI, le numéro de BA et la taille des ROIs sont indiqués dans le tableau 2. (B) Représentation visuelle des valeurs t pour CueE par rapport à la ligne de base (≥3 = rouge à jaune, ≤ -3 = bleu à bleu clair), (C) Valeurs T pour CueD par rapport à la ligne de base (≥3 = rouge à jaune, ≤ -3 = bleu à bleu clair). Les images sont en orientation neurologique (L = gauche, R = droite), les noms, abréviations, coordonnées MNI du voxel des pics d’activations se trouvent dans le tableau 1.

Tableau 3. Résultats du réseau.
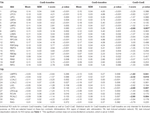
Tableau 4. Résultats du retour sur investissement.
Tests d’hypothèses
Nous avons testé les hypothèses suivantes dans cette étude :
Hypothèse 1 : Le TIA montrera un changement de signal accru pour le CueD, par rapport au CueE.
Hypothèse 2 : TID montrera une diminution du changement de signal pour CueD, par rapport à CueE.
Analyse statistique
L’analyse de puissance n’a pas été effectuée car c’était la première fois que cette conception de tâche spécifique était présentée aux participants. Par conséquent, il n’y a aucune connaissance du pourcentage de changement de signal attendu et de la variabilité des conditions (Desmond et Glover, 2002).
La précision de la tâche a été calculée pour StimE et StimD comme le pourcentage de réponses correctes. Les temps de réaction ont été calculés pour StimE et StimD sur l’ensemble des réponses correctes.
Des tests t à échantillon unique ont été utilisés pour comparer le pourcentage de changement de signal pour les TIA et TID par rapport à la ligne de base pour CueE et CueD. Des tests t unilatéraux à échantillons appariés ont été utilisés pour comparer le changement de signal, la précision et les différences de temps de réaction entre CueD et CueE (Hypothèse 1 et 2).
Les tests post hoc ont impliqué des tests t séparés pour chaque ROI dans chaque réseau. L’analyse des ROI a été corrigée par Bonferroni si le test omnibus du réseau n’était pas significatif. Nous présentons les valeurs p non corrigées et un commentaire indiquant si cette valeur p aurait survécu à la correction de Bonferroni pour toutes les comparaisons multiples. SPSS 24 a été utilisé pour toutes les analyses statistiques.
Résultats
Performance
La précision pour les stimuli faciles (« StimE ») était de 98% ± 1,2% SEM et pour les stimuli difficiles (« StimD ») 85% ± 2,6%. Le temps de réaction pour le StimE était de 682 ± 20 ms et pour le StimD de 1 138 ± 27 ms. Les deux conditions montrent des taux de précision suffisants pour être sûr que la tâche a été exécutée conformément aux instructions de tous les participants. Comme prévu, les participants ont répondu de manière moins précise (T = -4,3, p < 0,001) et plus lente (T = 17,8, p < 0,001) pour le StimD que pour le StimE (figure 3), ce qui indique que le contraste entre les stimuli faciles et difficiles a été efficace.
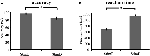
Figure 3. Résultats des performances. (A) Précision pour les deux catégories de stimulus, (B) temps de réaction pour les deux catégories de stimulus. Les barres d’erreur représentent l’erreur standard de la moyenne (SEM). *p ≤ 0.001. Abréviations : StimE, un indice indiquant un stimulus facile, suivi d’un stimulus facile ; StimD, un indice indiquant un stimulus difficile, suivi d’un stimulus difficile.
Immagerie par résonance magnétique fonctionnelle
Descriptifs
Le réseau TIA était composé de 20 ROIs, dont 10 étaient basés sur des maxima locaux pour le CueE, cinq étaient basés sur des maxima locaux pour le CueD, et cinq contenaient à la fois un maximum pour le CueE et le CueD (tableau 1). Sur ces 20 ROI, 19 présentaient une activité significative par rapport à la ligne de base pour le CueE, 18 pour le CueD (tableau 1). La modification moyenne du signal dans l’AIT par rapport à la ligne de base pour le CueE était de 0,12 ± 0,02 (t = 6,11, p < 0,001) et pour le CueD de 0,12 ± 0,02 (t = 7,61, p < 0,001).
Le réseau TID était composé de 11 ROIs, dont trois étaient basés sur des maxima locaux pour le CueE, six étaient basés sur des maxima locaux pour le CueD, et deux contenaient à la fois un maximum pour le CueE et le CueD (Tableau 1). Sur ces 11 ROIs, quatre présentaient une activité significative par rapport à la ligne de base pour le CueE, 10 pour le CueD (Tableau 1). Le changement moyen du signal dans la TID par rapport à la ligne de base pour le CueE était de -0,07 ± 0,02 (t = 2,68, p < 0,01), et pour le CueD -0,12 ± 0,02 (t = 5,37, p < 0,001 ; tableau 3).
Syntonisation à la difficulté attendue
L’augmentation du signal dans l’AIT n’était pas significativement plus forte pour CueD par rapport à CueE (t = -0,24, p = 0,41), ce qui indique que le niveau d’activation de l’AIT n’est pas syntonisé à la difficulté attendue (figure 4, tableau 3). L’analyse ROI post hoc n’a montré aucune des 20 ROI au sein de la TIA avec une augmentation significative du signal pour CueD par rapport à CueE après avoir appliqué la correction de Bonferroni (tableau 4, figure 5).
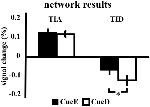
Figure 4. Vue d’ensemble des résultats du réseau. Les barres d’erreur représentent le SEM. *p ≤ 0,05 pour le repère difficile vs le repère facile. Abréviations : TIA, réseau d’activation induite par la tâche ; TID, réseau de désactivation induite par la tâche ; CueE, un indice indiquant un stimulus facile, non suivi d’un stimulus ; CueD, un indice indiquant un stimulus difficile, non suivi d’un stimulus.
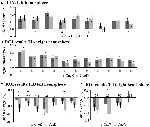
Figure 5. Aperçu des réponses des ROI individuelles au sein du réseau d’activation induite par la tâche, hémisphère gauche (A) et droit (B), et de la désactivation induite par la tâche, hémisphère gauche (C), et droit (D). Les barres d’erreur représentent le SEM. *p ≤ 0,05 pour CueD vs CueE, voir la figure 2 pour l’emplacement des ROI, voir le tableau 1 pour les noms, abréviations et coordonnées MNI des ROI.
La diminution du signal dans le TID était significativement plus forte pour CueD par rapport à CueE (T = -2,48, p = 0,01), ce qui indique que le niveau de TID est accordé à la difficulté attendue (tableau 3, figure 4). L’analyse ROI post hoc a montré que quatre des 11 ROI de la TID présentaient une diminution significative du signal pour le CueD par rapport au CueE, à savoir LMPFG (T = -1,83, p = 0,04), LSPG (T = -2,32, p = 0,02), LSTG (T = -2,69, p < 0,01) et RCALC (T = -2,90, p < 0,01). Ces résultats indiquent que l’accord sur la difficulté attendue est le plus fort dans les ROIs frontaux, temporaux et visuels gauches (tableau 4, figure 5).
Discussion
Dans cette étude, nous avons examiné si et comment la vigilance phasique est accordée à la difficulté attendue d’un défi cognitif à venir. La vigilance phasique s’est reflétée dans des régions cérébrales activées et désactivées. Le réseau activé comprenait des régions du réseau exécutif central. Le réseau désactivé comprenait des régions du DMN, ainsi que des cortex visuels. Le niveau de désactivation était proportionnel à la difficulté attendue du stimulus à venir, alors que le niveau d’activation ne l’était pas. Ces résultats suggèrent que la modulation de la vigilance phasique se reflète principalement dans les processus de suppression graduelle qui ne sont pas pertinents pour la tâche actuelle (par exemple les processus cardio-vagal, auditif et visuel). Il est possible que cela se produise parce que ces processus pourraient interférer avec les défis cognitifs à venir.
Les études d’imagerie précédentes sur la vigilance phasique utilisaient un seul niveau de difficulté, ne présentaient que les régions cérébrales activées (Shulman et al., 1999 ; Sturm et Willmes, 2001 ; Thiel et al., 2004 ; Fan et al., 2005 ; Périn et al., 2010 ; Yanaka et al., 2010), ou se concentraient uniquement sur l’activité du cortex visuel (Bartolucci et Smith, 2011). Ces études ont identifié un réseau fronto-pariétal-thalamique principalement latéralisé à droite, parfois combiné à des régions corticales motrices et visuelles, qui était activé par un indice. Il existe des différences substantielles dans les réseaux activés entre les études. Certaines des différences entre les réseaux dans les études précédentes peuvent être expliquées par la tâche qui suivait l’indice. Par exemple, Thiel et al. (2004) ont uniquement identifié une activation dans les régions corticales visuelles à l’aide d’une tâche de perception visuelle, tandis que Fan et al. (2005) et Yanaka et al. (2010) ont identifié une activation thalamique et motrice à l’aide d’une tâche de réponse motrice. Bien que Bartolucci et Smith (2011) présentent une conception élégante de tâche guidée avec quatre niveaux de difficulté d’une tâche de discrimination d’orientation, ils n’ont présenté que l’activation dans le cortex visuel. Par conséquent, il n’est pas clair comment les autres régions du cerveau ont répondu à cette tâche. Le réseau d’activation induit par la tâche, identifié dans l’étude actuelle est le plus similaire au réseau trouvé par Shulman et al. (1999), qui ont utilisé un type similaire de tâche de traitement visuel.
Il n’est pas clair si la vigilance phasique est une réponse ascendante ou descendante à un indice non informatif (Thiel et al., 2004 ; Hackley, 2009 ; Périn et al., 2010 ; Bartolucci et Smith, 2011 ; Chica et al., 2016). La vigilance phasique a été considérée par certains comme une réponse ascendante (Sturm et al., 1999 ; Hackley, 2009), par d’autres comme une réponse descendante (Bartolucci et Smith, 2011), et par d’autres encore comme une combinaison (Thiel et al., 2004 ; Périn et al., 2010). Nous soutenons qu’il est plus approprié d’étiqueter la réponse du cerveau à un indice comme une combinaison de traitement ascendant et descendant parce que les participants répondent à la fois à un indice externe et à une instruction associée à cet indice. Cependant, nos principaux résultats concernent la différence de réponse à deux indices similaires indiquant un type différent de stimulus de tâche. Par conséquent, nous soutenons que la différence qui en résulte entre l’indice indiquant une tâche difficile et l’indice indiquant une tâche facile peut représenter un niveau de contrôle descendant lié à l’interprétation de l’indice et de l’instruction associée.
Le réseau de désactivation induit par la tâche comprenait des régions cérébrales du DMN, à savoir le gyrus préfrontal médian, les gyri temporaux supérieurs et les gyri angulaires (Shulman et al., 1999 ; Raichle et al., 2001 ; Raichle, 2015). Il est communément admis que la désactivation du DMN aide à la performance des tâches en réduisant les processus internes qui interfèrent avec les défis cognitifs (Raichle et al., 2001 ; Buckner et al., 2008 ; Raichle, 2015). Ce point de vue est soutenu par des études montrant que le niveau de désactivation du DMN varie en fonction de la difficulté d’une tâche pendant son exécution (McKiernan et al., 2003 ; Singh et Fawcett, 2008). Ces études ont examiné la désactivation pendant l’exécution de la tâche. Nos résultats suggèrent que cette mise à l’échelle peut déjà se produire pendant la phase d’anticipation de la tâche. Weissman et al. (2006) ont examiné la variabilité des temps de réaction individuels pour identifier les pertes d’attention. Les pertes d’attention pourraient être associées à une désactivation réduite du DMN. Alors que (Weissman et al., 2006) ont examiné la variation naturelle du niveau de vigilance, nos résultats indiquent que la désactivation dans plusieurs régions du DMN peut également être réglée d’une manière descendante avant que le stimulus de la tâche ne soit présenté.
Les effets de réglage les plus profonds ont été trouvés dans les régions préfrontale médiane gauche, temporale et visuelle. Nous discutons ci-dessous des implications possibles de ces effets pour ces régions en relation avec leur fonction proposée.
L’activité du cortex préfrontal médian a précédemment été associée à la déambulation de l’esprit (Bertossi et al., 2017), à la récupération de la mémoire (Euston et al., 2012) et au contrôle cardiovagal (Wong et al., 2007). Cette désactivation préfrontale médiane suggère que l’une de ces fonctions est déjà supprimée en prévision d’un défi cognitif.
L’accord de la désactivation à la difficulté attendue dans les régions visuelles et temporelles peut être lié à la suppression des entrées sensorielles visuelles et auditives non pertinentes. L’accord dans les régions temporales bilatérales peut être spécifiquement lié à la suppression du bruit généré par le scanner IRM. Il est raisonnable de s’attendre à ce que le niveau sonore soit similaire dans les deux conditions. Le fait que le niveau de désactivation soit plus fort pour les indices difficiles suggère que le traitement du son ambiant est supprimé plus fortement si une tâche difficile est attendue. La désactivation dans les cortex visuels est moins souvent rapportée que la désactivation dans les régions temporales. Cependant, Smith et al. (2000) ont précédemment rapporté une association entre une désactivation étendue dans le cortex visuel et l’attention à une partie spécifique d’une image. Giesbrecht et al. (2006) ont également signalé une modulation de l’activation visuelle associée à l’attention secrète portée aux objets situés près du centre de leur champ visuel par rapport aux objets situés dans le champ visuel périphérique. Ces résultats indiquent que l’activation dans les cortex visuels peut être modulée par une attention secrète sur des régions fovéales ou périphériques. Notre étude ajoute une nouvelle dimension à ces résultats, car elle suggère que l’activation dans les cortex visuels n’est pas seulement modulée par la localisation de l’attention visuelle secrète, mais aussi par la difficulté attendue d’un défi visuel ; et puisque les indices étaient identiques en termes de localisation et de taille, ce processus semble régulé de manière descendante.
Nous avons également identifié un ensemble de régions cérébrales qui ont montré une activation accrue en prévision d’un défi cognitif. Ce réseau a montré une similarité avec le réseau exécutif central qui a été précédemment associé à l’exécution de tâches de mémoire de travail (Lawrence et al., 2003). Cependant, l’activation dans ce réseau n’était pas adaptée à la difficulté attendue de la tâche. Ceci suggère que ces régions représentent des processus qui sont similaires pour les conditions difficiles et faciles. Il est possible que l’activité dans ce réseau soit associée à l’évaluation de l’indice, ou à la récupération et au maintien du contexte de la tâche et des instructions.
Il faut tenir compte de certaines limites qui peuvent affecter l’interprétation de nos résultats. Premièrement, nous n’avons pas inclus d’essais avec des stimuli qui n’étaient pas précédés d’un indice, il n’est donc pas possible d’examiner l’effet de l’indice sur la performance cognitive. En raison de la restriction de temps, il n’a pas été possible de répéter notre tâche en utilisant des stimuli identiques mais sans indices.
Deuxièmement, nous avons utilisé un point d’exclamation comme partie de l’indice indiquant un défi cognitif difficile parce que ce symbole est généralement utilisé s’il y a un besoin d’augmenter la vigilance. Il est possible que le point d’exclamation lui-même ait joué un rôle dans les différents schémas d’activation pour la condition facile et difficile, en raison de sa signification inhérente. Cela n’affecte toutefois pas l’interprétation principale de nos résultats, si ce n’est que nos principaux résultats peuvent être classés comme une réponse ascendante au lieu d’une réponse descendante. Enfin, notre plan expérimental ne nous permet pas d’examiner si l’activité liée à la vigilance phasique peut être généralisée à d’autres domaines, ou si elle est spécifique à un domaine, car il ne comprenait qu’un défi cognitif visuo-perceptif.
Pour conclure, dans cette étude, nous avons montré que l’accord de la vigilance phasique est représenté par le niveau de désactivation dans plusieurs régions. Cet effet est le plus fort dans le cortex préfrontal médian, visuel et temporal, ce qui peut refléter une suppression du contrôle cardiovagal, du traitement visuel dans le champ visuel périphérique et une suppression du bruit du scanner IRM. Ces résultats suggèrent que la performance cognitive est facilitée par un état du cerveau qui est étroitement couplé aux attentes concernant la difficulté d’un défi cognitif à venir.
Data Availability
Les données brutes ont été générées à l’hôpital Elisabeth-Tweesteden. Les données dérivées qui soutiennent les conclusions de cette étude sont disponibles auprès de l’auteur correspondant sur demande raisonnable.
Déclaration éthique
Cette étude a été réalisée conformément aux recommandations de la loi néerlandaise sur le soutien social, comité d’éthique médicale Brabant. Tous les sujets ont donné un consentement éclairé écrit conformément à la Déclaration d’Helsinki. Le protocole a été approuvé par le comité d’éthique médicale Brabant.
Contributions des auteurs
MD et JJ ont rédigé le manuscrit principal et préparé les figures. MD et IS ont réalisé les expériences. G-JR, NR et JJ ont supervisé conjointement le travail. Tous les auteurs ont revu le manuscrit.
Funding
Cette étude a été financée par ZonMW, une organisation nationale néerlandaise (Organisation néerlandaise pour la recherche et le développement dans le domaine de la santé, ZONMW ; numéro de projet : 842003004), titre du projet : Mise en œuvre clinique de techniques d’IRM avancées pour la localisation et le suivi des fonctions sensorimotrices et cognitives chez les patients atteints de tumeurs cérébrales.
Déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière qui pourrait être interprétée comme un conflit d’intérêts potentiel.
Remerciements
Nous tenons à remercier les radiographes William Pigmans et Maikel Brands pour leur contribution à cette étude.
Abréviations
DMN, default mode network ; M, homme ; F, femme ; GLM, general linear model ; SPM, statistical parametric mapping ; CueE, un cue indiquant un stimulus facile, non suivi d’un stimulus ; CueD, un cue indiquant un stimulus difficile, non suivi d’un stimulus ; StimE, un indice indiquant un stimulus facile, suivi d’un stimulus facile ; StimD, un indice indiquant un stimulus difficile, suivi d’un stimulus difficile ; IRM, imagerie par résonance magnétique ; ROI, région d’intérêt ; GDL, langage de données GNU ; TIA, réseau d’activation induite par la tâche ; TID, réseau de désactivation induite par la tâche ; SEM, erreur standard de la moyenne.
Notes de bas de page
- ^ https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/project-detail/topzorg/clinical-implementation-of-advanced-mri-techniques-for-localization-and-monitoring-of-sensorimotor-a/verslagen/
- ^ http://www.fil.ion.ucl.ac.uk/spm/software/spm12/
- ^ https://github.com/gnudatalanguage/gdl
Bartolucci, M., et Smith, A. T. (2011). La modulation attentionnelle dans le cortex visuel est modifiée pendant l’apprentissage perceptif. Neuropsychologia 49, 3898-3907. doi : 10.1016/j.neuropsychologia.2011.10.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bertossi, E., Peccenini, L., Solmi, A., Avenanti, A., et Ciaramelli, E. (2017). La stimulation transcrânienne à courant continu du cortex préfrontal médian amortit l’errance mentale chez les hommes. Sci. Rep. 7:16962. doi : 10.1038/s41598-017-17267-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Buckner, R. L., Andrews-Hanna, J. R., et Schacter, D. L. (2008). Le réseau par défaut du cerveau : anatomie, fonction et pertinence pour la maladie. Ann. N Y Acad. Sci. 1124, 1-38. doi : 10.1196/annals.1440.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Buracas, G. T., et Boynton, G. M. (2002). Conception efficace d’expériences d’IRMf liées aux événements en utilisant des séquences M. Neuroimage 16, 801-813. doi : 10.1006/nimg.2002.1116
PubMed Abstract | CrossRef Full Text | Google Scholar
Čeko, M., Gracely, J. L., Fitzcharles, M. A., Seminowicz, D. A., Schweinhardt, P., et Bushnell, M. C. (2015). Is a responsive default mode network required for successful working memory task performance ? J. Neurosci. 35, 11595-11605. doi : 10.1523/JNEUROSCI.0264-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Chica, A. B., Bayle, D. J., Botta, F., Bartolomeo, P., et Paz-Alonso, P. M. (2016). Interactions entre l’alerte phasique et la conscience dans le réseau fronto-striatal. Sci. Rep. 6:13. doi : 10.1038/srep31868
PubMed Abstract | CrossRef Full Text | Google Scholar
Desmond, J. E., and Glover, G. H. (2002). Estimation de la taille de l’échantillon dans les études de neuro-imagerie par IRM fonctionnelle (IRMf) : analyses de puissance statistique. J. Neurosci. Methods 118, 115-128. doi : 10.1016/s0165-0270(02)00121-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Euston, D. R., Gruber, A. J., et McNaughton, B. L. (2012). Le rôle du cortex préfrontal médian dans la mémoire et la prise de décision. Neuron 76, 1057-1070. doi : 10.1016/j.neuron.2012.12.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Fossella, J., Flombaum, J. I., et Posner, M. I. (2005). The activation of attentional networks. Neuroimage 26, 471-479. doi : 10.1016/j.neuroimage.2005.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Sommer, T., Raz, A., et Posner, M. I. (2002). Test de l’efficacité et de l’indépendance des réseaux attentionnels. J. Cogn. Neurosci. 14, 340-347. doi : 10.1162/089892902317361886
PubMed Abstract | CrossRef Full Text | Google Scholar
Giesbrecht, B., Weissman, D. H., Woldorff, M. G., and Mangun, G. R. (2006). Pre-target activity in visual cortex predicts behavioral performance on spatial and feature attention tasks. Brain Res. 1080, 63-72. doi : 10.1016/j.brainres.2005.09.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Hackley, S. A. (2009). L’accélération de la réaction volontaire par un signal d’avertissement. Psychophysiologie 46, 225-233. doi : 10.1111/j.1469-8986.2008.00716.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Härmä, M., Partinen, M., Repo, R., Sorsa, M., et Siivonen, P. (2008). Effets des systèmes de veille 6/6 et 4/8 sur la somnolence chez les officiers de pont. Chronobiol. Int. 25, 413-423. doi : 10.1080/07420520802106769
PubMed Abstract | CrossRef Full Text | Google Scholar
Hedden, T., Van Dijk, K. R., Shire, E. H., Sperling, R. A., Johnson, K. A., and Buckner, R. L. (2012). L’incapacité à moduler le contrôle attentionnel dans le vieillissement avancé est liée à la pathologie de la substance blanche. Cereb. Cortex 22, 1038-1051. doi : 10.1093/cercor/bhr172
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., Ramsey, N. F., de Zwart, J. A., van Gelderen, P., and Duyn, J. H. (2007). fMRI study of effort and information processing in a working memory task. Hum. Brain Mapp. 27, 431-440. doi : 10.1002/hbm.20297
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., et Rutten, G. J. (2017). » A proposal for a system that facilitates quantitative replication of fMRI studies « , in Proceedings of the Human Brain Mapping Conference 2017 June 25-29, Vancouver, Canada. Disponible en ligne à l’adresse suivante : https://archive.aievolution.com/2017/hbm1701/index.cfm?do=abs.viewAbs&abs=4047.
Google Scholar
Kriegeskorte, N., Simmons, W. K., Bellgowan, P. S., et Baker, C. I. (2009). Analyse circulaire dans la neuroscience des systèmes : les dangers de double dipping. Nat. Neurosci. 12, 535-540. doi : 10.1038/nn.2303
PubMed Abstract | CrossRef Full Text | Google Scholar
Kusnir, F., Chica, A. B., Mitsumasu, M. A., et Bartolomeo, P. (2011). L’alerte auditive phasique améliore la perception consciente visuelle. Conscious. Cogn. 20, 1201-1210. doi : 10.1016/j.concog.2011.01.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Lawrence, M. A., Ross, T. J., Hoffmann, H. G., and Stein, E. S. (2003). Multiple neural networks mediate sustained attention. J. Cogn. Neurosci. 15, 1028-1038. doi : 10.1162/089892903770007416
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, G., Sobering, G., Duyn, J., et Moonen, C. T. (1993). Une technique d’IRM fonctionnelle combinant les principes de l’écho-décalage avec un train d’observations (PRESTO). Magn. Reson. Med. 30, 764-768. doi : 10.1002/mrm.1910300617
PubMed Abstract | CrossRef Full Text | Google Scholar
Macleod, J. W., Lawrence, M. A., McConnell, M. M., Eskes, G. A., Klein, R. M., and Shore, D. I.. (2010). Appraising the ANT : psychometric and theoretical considerations of the attention network test. Neuropsychologie 24, 637-651. doi : 10.1037/a0019803
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., D’Angelo, B. R. D., Kaufman, J. N., and Binder, J. R. (2006). Interruption du « courant de conscience » : une enquête par IRMf. Neuroimage 29, 1185-1191. doi : 10.1016/j.neuroimage.2005.09.030
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., Kaufman, J. N., Kucera-Thompson, J. K., et Binder, J. R. (2003). Une manipulation paramétrique des facteurs affectant la désactivation induite par la tâche en neuroimagerie fonctionnelle. J. Cogn. Neurosci. 15, 394-408. doi : 10.1162/089892903321593117
PubMed Abstract | CrossRef Full Text | Google Scholar
Nebes, R. D., et Brady, C. B. (1993). Vigilance phasique et tonique dans la maladie d’Alzheimer. Cortex 29, 77-90. doi : 10.1016/s0010-9452(13)80213-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Neggers, S. F., Hermans, E. J., and Ramsey, N. F. (2008). Enhanced sensitivity with fast three-dimensional blood-oxygen-level-dependent functional MRI : comparison of SENSE-PRESTO and 2D-EPI at 3 T. NMR Biomed. 21, 663-676. doi : 10.1002/nbm.1235
PubMed Abstract | CrossRef Full Text | Google Scholar
Périn, B., Godefroy, O., Fall, S., et de Marco, G. (2010). La vigilance chez les jeunes sujets sains : une étude par IRMf de l’interactivité des régions cérébrales renforcée par un signal d’alerte. Brain Cogn. 72, 271-281. doi : 10.1016/j.bandc.2009.09.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pyka, M., Beckmann, C. F., Schöning, S., Hauke, S., Heider, D., Kugel, H., et al. (2009). Impact of working memory load on FMRI resting state pattern in subsequent resting phases. PLoS One 4:e7198. doi : 10.1371/journal.pone.0007198
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E. (2015). Le réseau du mode par défaut du cerveau. Annu. Rev. Neurosci. 38, 433-447. doi : 10.1146/annurev-neuro-071013-014030
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E., MacLeod, J. W., Snyder, A. Z., Powers, W. J., Gusnard, D. A., et Shulman, G. L. (2001). A default mode of brain function. Proc. Natl. Acad. Sci. U S A 98, 676-682. doi : 10.1073/pnas.98.2.676
PubMed Abstract | CrossRef Full Text | Google Scholar
Shulman, G. L., Ollinger, J. M., Akbudak, E., Conturo, T. E., Snyder, A. Z., Petersen, S. E., et al. (1999). Areas involved in encoding and applying directional expectations to moving objects. J. Neurosci. 19, 9480-9496. doi : 10.1523/jneurosci.19-21-09480.1999
PubMed Abstract | CrossRef Full Text | Google Scholar
Singh, K. D., et Fawcett, I. P. (2008). Désactivation transitoire et linéairement graduelle du réseau humain en mode par défaut par une tâche de détection visuelle. Neuroimage 41, 100-112. doi : 10.1016/j.neuroimage.2008.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, A. T., Singh, K. D., and Greenlee, M. W. (2000). Suppression attentionnelle de l’activité dans le cortex visuel humain. Neuroreport 11, 271-277. doi : 10.1097/00001756-200002070-00010
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., de Simone, A., Krause, B. J., Specht, K., Hessemann, V., Radermacher, I., et al. (1999). Anatomie fonctionnelle de la vigilance intrinsèque : preuve d’un réseau froto-pariétal-thalamique-brainstem dans l’hémisphère droit. Neuropsychologia 37, 797-805. doi : 10.1016/s0028-3932(98)00141-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., et Willmes, K. (2001). Sur la neuroanatomie fonctionnelle de la vigilance intrinsèque et phasique. Neuroimage 14, S76-S84. doi : 10.1006/nimg.2001.0839
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, C. M., Zilles, K., et Fink, G. R. (2004). Corrélats cérébraux de l’alerte, de l’orientation et de la réorientation de l’attention visuospatiale : une étude IRMf liée aux événements. Neuroimage 21, 318-328. doi : 10.1016/j.neuroimage.2003.08.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. Neuroimage 15, 273-289. doi : 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
van Gelderen, P., Ramsey, N. F., Liu, G., Duyn, J. H., Frank, J. A., Weinberger, D. R., et al. (1995). Three-dimensional functional magnetic resonance imaging of human brain on a clinical 1.5-T scanner. Proc. Natl. Acad. Sci. U S A 92, 6906-6910. doi : 10.1073/pnas.92.15.6906
PubMed Abstract | CrossRef Full Text | Google Scholar
Weinbach, N., et Henik, A. (2011). La vigilance phasique peut moduler le contrôle exécutif en améliorant le traitement global des stimuli visuels. Cognition 121, 454-458. doi : 10.1016/j.cognition.2011.08.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Weissman, D. H., Roberts, K. C., Visscher, K. M., et Woldorff, M. G. (2006). Les bases neuronales des lapsus momentanés dans l’attention. Nat. Neurosci. 9, 971-978. doi : 10.1038/nn1727
PubMed Abstract | CrossRef Full Text | Google Scholar
Wong, S. W., Massé, N., Kimmerly, D. S., Menon, R. S., and Shoemaker, J. K. (2007). Ventral medial prefrontal cortex and cardiovagal control in conscious humans. Neuroimage 35, 698-708. doi : 10.1016/j.neuroimage.2006.12.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanaka, H. T., Saito, D. N., Uchiyama, Y., et Sadato, N. (2010). Les substrats neuronaux de la vigilance phasique : une étude d’imagerie par résonance magnétique fonctionnelle. Neurosci. Res. 68, 51-58. doi : 10.1016/j.neures.2010.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar
.