Introduction
Vorig onderzoek toont aan dat mensen een cue kunnen gebruiken om zich mentaal voor te bereiden op een cognitieve uitdaging. Als deelnemers worden geïnstrueerd om zich mentaal voor te bereiden op het moment dat een cue wordt gepresenteerd, is dit gedefinieerd als fasische alertheid. De mogelijkheid om ons niveau van alertheid te beïnvloeden kan belangrijk zijn, vooral als alertheid ook een prijs heeft. Als de vraag naar alertheid te hoog is, zou dit kunnen leiden tot vermoeidheid (Härmä et al., 2008) of stress-gerelateerde problemen. In deze studie willen we onderzoeken of en hoe gezonde volwassenen hun alertheidsniveau afstemmen op de verwachte moeilijkheidsgraad van een aankomende cognitieve taak.
Als een cue vlak voor een taakstimulus wordt gepresenteerd, zijn mensen over het algemeen in staat om sneller te reageren in eenvoudige motorische reactietaken (Fan et al., 2002; Macleod et al., 2010; Weinbach en Henik, 2011) en nemen gedegradeerde visuele stimuli nauwkeuriger waar (Kusnir et al., 2011). Beeldvormingsstudies hebben aangetoond dat fasische alertheid geassocieerd is met verhoogde activatie in frontale, pariëtale, thalamische (Shulman et al., 1999; Fan et al., 2005; Yanaka et al., 2010), temporo-occipitale (Thiel et al., 2004), en visuele hersengebieden (Bartolucci and Smith, 2011). Deze beeldvormingsstudies hebben waardevolle informatie opgeleverd over de representatie van fasische alertheid in de hersenen. Echter, fasische alertheid is over het algemeen bestudeerd als een aan/uit fenomeen of de analyse is beperkt tot de visuele cortex. Daarom is het onduidelijk of alertheid ook de verwachte moeilijkheid van de cognitieve uitdaging in hele hersennetwerken weerspiegelt.
Daarnaast hebben eerdere studies aangegeven dat deactivering van hersengebieden die deel uitmaken van het default mode netwerk (DMN) cognitieve taakuitvoering kan vergemakkelijken. Ten eerste laten studies van taakuitvoering zien dat een toenemende moeilijkheidsgraad van de taak geassocieerd is met toenemende deactivering (McKiernan et al., 2003, 2006; Jansma et al., 2007; Singh and Fawcett, 2008; Pyka et al., 2009; Hedden et al., 2012; Čeko et al., 2015). Ten tweede hebben Jansma et al. (2007) aangetoond dat het mediale prefrontale deel van het DMN alleen afstemt op de taakmoeilijkheid, die de deelnemer kon anticiperen, maar niet werd beïnvloed door de feitelijke moeilijkheidsgraad van elke stimulus, die de deelnemer niet kon anticiperen. Tenslotte vonden Weissman et al. (2006) dat de deactivering in het DMN vlak voor de stimulus zwakker was als proefpersonen relatief langzaam reageerden. Misschien reageerden deze proefpersonen langzamer omdat ze tijdelijk minder alert waren.
Voor onze studie ontwierpen we een cued visuele perceptie taak met een makkelijke en moeilijke conditie. De cues gaven informatie over de moeilijkheid van de komende stimulus, maar gaven geen informatie die de taak zelf zou vergemakkelijken. In de helft van de trials werd de cue niet gevolgd door een stimulus. Alleen deze trials werden geanalyseerd op hersenactiviteit, zodat we activatie geassocieerd met de cue, volledig konden isoleren van activatie geassocieerd met taakuitvoering. We veronderstellen dat deelnemers hun activiteit afstemmen op de verwachte moeilijkheidsgraad van de taak.
Materialen en Methoden
Deelnemers
Deelnemers werden gerekruteerd via online advertentie. Deelnemers met een voorgeschiedenis van neurologische of psychiatrische aandoeningen of contra-indicaties voor MRI (magnetic resonance imaging) (metalen voorwerpen in of om het lichaam, claustrofobie of zwangerschap) werden uitgesloten. Deze studie werd uitgevoerd in overeenstemming met de aanbevelingen van de Wet Medisch-wetenschappelijk Onderzoek met mensen (WMO), Medisch Ethische Commissie Brabant. Het protocol werd goedgekeurd door de Commissie Medisch Ethisch Onderzoek (protocolnummer: NL51147.028.14). Alle proefpersonen gaven schriftelijke geïnformeerde toestemming in overeenstemming met de Verklaring van Helsinki.
Tweeëntwintig gezonde rechtshandige vrijwilligers namen deel aan het onderzoek. De gegevens van twee deelnemers werden uitgesloten wegens scannerartefacten. Resultaten worden gerapporteerd voor de overige 20 deelnemers.
Taakontwerp
We ontwierpen een taak (met gebeurtenis-gerelateerd ontwerp) dat ons in staat stelde om anticipatie-effecten met betrekking tot de verwachte moeilijkheid van een taak te onderzoeken, zonder verwarrende effecten van de uitvoering van de taak.
Taakstimuli bestonden uit negen pijlen in een drie bij drie lay-out op een zwart scherm (figuur 1). Een “gemakkelijke stimulus” bevatte acht pijlen in de juiste richting en één pijl in de tegenovergestelde richting. Een “moeilijke stimulus” bevatte vijf pijlen in de juiste richting en vier pijlen in de tegenovergestelde richting (figuur 1). Deelnemers werden geïnstrueerd om op een knop te drukken met de hand die overeenkomt met de richting van de meerderheid van de pijlen. Makkelijke en moeilijke stimuli werden gepresenteerd in een willekeurige volgorde. De baseline stimuli bestonden uit een stilstaand zwart scherm met de tekst: “u heeft 30 seconden pauze” in het Nederlands en in witte letters. De stimuli werden gepresenteerd door “presentatie” software.
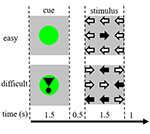
Figuur 1. Weergave van de visuele stimuli. Elke proef duurde 4,5 s. In de helft van de proeven werd de cue niet gevolgd door een stimulus. Deze trials werden gebruikt voor de functionele magnetische resonantie imaging (fMRI) analyse.
Elke trial begon met een cue die de moeilijkheidsgraad van de vervolgens gepresenteerde stimulus aangaf. Een groene stip gaf een “makkelijke stimulus” aan, een groene stip met een uitroepteken een “moeilijke stimulus” (figuur 1).
In de helft van de trials werd de cue niet gevolgd door een stimulus, in de andere helft werd de stimulus gepresenteerd 500 ms nadat de cue verdween. Dit resulteerde in vier condities: (1) een cue voor een makkelijke stimulus, niet gevolgd door een stimulus (“CueE”); (2) een cue voor een moeilijke stimulus, niet gevolgd door een stimulus (“CueD”); (3) een cue voor een makkelijke stimulus, gevolgd door een makkelijke stimulus (“StimE”); en (4) een cue voor een moeilijke stimulus, gevolgd door een moeilijke stimulus (“StimD”). Alle condities werden gecontrasteerd met de basislijn. Functionele MRI (fMRI) resultaten waren gebaseerd op CueE en CueD. Prestatie resultaten waren gebaseerd op StimE en StimD. CueE en CueD werden gepresenteerd in een pseudo-willekeurige volgorde met behulp van M-sequenties om het algemeen lineair model (GLM) regressor onafhankelijkheid tussen de condities te maximaliseren en de efficiëntie van het ontwerp te optimaliseren (Buracas en Boynton, 2002). De deelnemers konden niet voorspellen of een cue zou worden gevolgd door een stimulus of niet.
De duur van elke proef was 4.500 ms. Cues werden gepresenteerd op t = 0 gedurende 1.500 ms en stimuli werden gepresenteerd op t = 2.000, eveneens gedurende 1.500 ms (figuur 1). De taak werd uitgevoerd in twee runs van 68 trials. De basislijn bestond uit drie rustperiodes van 30 seconden, voor, na en tussen de twee reeksen. De totale duur van de taak was 11,7 min. Dit was de tweede taak van de sessie en begon nadat de deelnemers ongeveer 10 min in de scanner hadden gelegen.
Deelnemers werden geïnstrueerd om zich voor te bereiden op een makkelijke of moeilijke stimulus op basis van de informatie van de cue (figuur 1) en om zo nauwkeurig en snel mogelijk de richting aan te geven van het merendeel van de pijlen in de stimulus. Deelnemers oefenden de taak buiten de scanner na een standaard praktijk protocol van 3 min. Dit protocol werd herhaald als de prestaties onvoldoende waren (minder dan 70% nauwkeurigheid voor de moeilijke stimuli).
Een spiegel bevestigd aan het hoofd spoel konden de deelnemers zien een doorzichtige projectiescherm gepositioneerd achter het hoofd. Een video-projector in de scanner kamer geprojecteerd de taak stimuli op het scherm. Twee pneumatische drukknop dozen met luchtdruk werden gebruikt om reacties te registreren. Deelnemers gebruikten de linker duim of wijsvinger voor het beantwoorden van “links” en de rechter voor het beantwoorden van “rechts.”
Image Acquisition
Scans werden uitgevoerd op een 3T Philips Achieva scanner (Philips Medical Systems, Best, Nederland) met behulp van een 32-kanaals SENSE hoofdspoel. Een 3D T1-gewogen structureel beeld werd verkregen voor anatomische registratiedoeleinden. fMRI-beelden werden verkregen met behulp van een 3D PRESTO pulssequentie. Zes dummy scans werden verkregen en vervolgens weggegooid door de scanner.
Image Pre-processing
fMRI-gegevens werden voorbewerkt met behulp van statistische parametrische mapping (SPM12; Wellcome Trust Centre for Neuroimaging, University College London, Londen, UK2). Scans van een sessie werden opnieuw uitgelijnd op de eerste scan om te corrigeren voor onderwerp beweging met behulp van een kleinste kwadraten aanpak, een zes-parameter (starre lichaam) ruimtelijke transformatie, en een 2e graad B-spline schatting. De scans werden gecoregistreerd op de T1 met behulp van een rigid body model. De parameters werden geschat met behulp van de genormaliseerde wederzijdse informatiefunctie. De beelden werden opnieuw gesneden door een 4e graad B-spline. De T1 werd ruimtelijk genormaliseerd in standaard MNI-ruimte met behulp van zeer lichte bias regularisatie (0,0001) en een 4e graads B-Spline. De resulterende parameters werden toegepast op alle functionele scans om anatomische verschillen te minimaliseren en daardoor groepsanalyse mogelijk te maken. Ten slotte werden alle scans ruimtelijk afgevlakt met een 3D Gaussiaans filter (full-width at half-maximum: 8 mm) om het effect van functionele anatomische verschillen verder te minimaliseren.
Individuele fMRI-analyse
Event-gerelateerde GLM-regressieanalyse werd uitgevoerd voor elke voxel om individuele activeringskaarten te genereren met behulp van een massa-univariate benadering met een globale benaderende AR (1) autocorrelatie model, en een high pass filter (128 s cut-off). De basislijn werd niet expliciet gemodelleerd. De basisfunctie was een canonieke HRF zonder afgeleiden. Er werd een maskeerdrempel van 0,8 gebruikt. Afzonderlijke regressoren werden gebruikt voor elke conditie (CueE, 17 tijdpunten; CueD, 16 tijdpunten; StimE, 17 tijdpunten; StimD, 18 tijdpunten; en een hinderlijke regressor voor blancoperiodes in de taak gerelateerd aan de m-sequentie, 68 tijdpunten). Er werden geen tijdstippen uitgesloten van de analyse. Beta-kaarten werden getransformeerd om de werkelijke procentuele signaalverandering in elke voxel weer te geven. We presenteren alleen de resultaten voor de CueE en CueD regressoren, die signaalveranderingen weergeven voor cues zonder een stimulus. Beta en statistische t-maps werden visueel gecontroleerd op grote artefacten.
Groep fMRI Analyse
Een tweede niveau fMRI-analyse werd uitgevoerd met lineaire regressie op elke voxel voor visualisatie en regio van belang (ROI) selectie. Een ROI-analyse werd uitgevoerd met GNU data taal (GDL3), met behulp van individuele onderwerp percentage signaal verandering kaarten gegenereerd door de GLM-analyse. De voxels binnen een ROI of netwerk werden gemiddeld om het signaal verschil tussen CueE, CueD, en baseline.
ROI Selectie
Supratentoriale lokale maxima en minima werden bepaald voor zowel CueE en CueD door SPM met een ongecorrigeerde drempel (p < 0,001; tabel 1). Kubische ROI’s van vooraf gedefinieerde grootte en vorm werden geplaatst over de lokale maxima voor het CueE-baseline en CueD-baseline contrast afzonderlijk binnen een vooraf gedefinieerd raster (Jansma en Rutten, 2017; Tabel 2). ROI’s werden opgenomen in de analyse als ze een significant lokaal maximum voor CueE of CueD bevatten. Door ROI’s te definiëren op lokale maxima voor beide condities afzonderlijk voorkomen we bias naar ofwel CueE of CueD. Bovendien is de vooraf gedefinieerde vorm en grootte van de ROI’s binnen een raster vermindert het effect van circulariteit, omdat de grenzen van deze ROI’s worden niet beïnvloed door ruis (Kriegeskorte et al., 2009). Bovendien is deze methode vergemakkelijkt kwantitatieve vergelijking van de resultaten tussen de voorwaarden, en mogelijk tussen verschillende studies, waardoor de kwantitatieve reproduceerbaarheid van fMRI resultaten. Plaatsing van de ROI’s over de lokale maxima geoptimaliseerd vermogen. Echter, de locatie van de activiteit piek is bekend te worden beïnvloed door ruis, dus de exacte locatie van de ROI’s kan altijd reproduceren voor elke ROI. Dit heeft geen invloed op de resultaten van het netwerk, omdat alle ROI’s worden gemiddeld en de exacte locatie, dus is niet zo relevant.
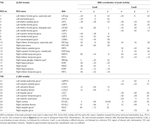
Tabel 1. Activiteitenpatroon.
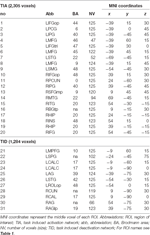
Tabel 2. Regio van belang (ROI) kenmerken.
ROI’s over regio’s met een toename van het signaal verandering werden gecombineerd in een taak-geïnduceerde activering netwerk (“TIA”). ROI’s over regio’s met een daling van het signaal verandering werden gecombineerd in een taak-geïnduceerde deactivering netwerk (“TID”; TABEL 1, 2). Waar mogelijk werden de ROI namen bepaald met behulp van de AAL atlas (Tzourio-Mazoyer et al., 2002).
Tabel 2 en figuur 2 geven een overzicht van de grootte en de locatie van alle ROI’s. Omdat de grootte en de grenzen van de ROI’s zijn vooraf bepaald, is het mogelijk dat de gemiddelde activiteit in de ROI is niet significant verschillend van de basislijn, bijvoorbeeld omdat het aantal geactiveerde voxels binnen de ROI is relatief klein. Hoewel de gemiddelde activiteit op netwerkniveau significant verschillend is van de basislijn voor alle condities (Tabel 3), is dit niet het geval voor acht van de 31 individuele ROI’s voor CueE en drie van de 31 ROI’s voor CueD (Tabel 4). Alleen voxels die signaal bevatte voor elke deelnemer werden opgenomen in de analyse. De maximale grootte van een ROI is 125 voxels, sommige ROI’s omvatten minder dan 125 voxels omdat ze zijn gepositioneerd in de buurt van de schedel.
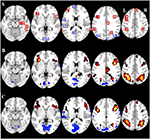
Figuur 2. Overzicht van de regio van belang (ROI) locatie en de hele hersenen fMRI resultaten. (A) ROI’s voor taak geïnduceerde activering (rood) en taak geïnduceerde deactivering (blauw) noot: ROI 22 wordt niet weergegeven omdat de locatie buiten de gekozen schijfjes. MNI coördinaten, BA-nummer, en de grootte van de ROI’s is te vinden in tabel 2. (B) Visuele weergave van de t-waarden voor CueE vs basislijn (≥ 3 = rood naar geel, ≤ -3 = blauw naar licht blauw), (C) T-waarden voor CueD vs basislijn (≥ 3 = rood naar geel, ≤ -3 = blauw naar licht blauw). Beelden zijn in neurologische oriëntatie (L = links, R = rechts), namen, afkortingen, MNI-coördinaten van de piek activaties voxel is te vinden in tabel 1.

Tabel 3. Netwerkresultaten.
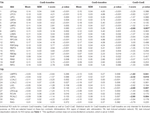
Tabel 4. ROI results.
Hypotheses Testing
Wij hebben in deze studie de volgende hypotheses getest:
Hypothese 1: TIA zal een verhoogde signaalverandering vertonen voor CueD, in vergelijking met CueE.
Hypothese 2: TID zal een verminderde signaalverandering laten zien voor CueD, vergeleken met CueE.
Statistische analyse
Power analyse werd niet uitgevoerd omdat het de eerste keer was dat deze specifieke taakopzet werd voorgelegd aan de deelnemers. Daarom is er geen kennis van de verwachte procentuele signaalverandering en variabiliteit van de condities (Desmond en Glover, 2002).
Taaknauwkeurigheid werd berekend voor StimE en StimD als het percentage correcte responsen. Reactietijden werden berekend voor StimE en StimD over alle correcte responsen.
Eenzijdige t-testen werden gebruikt om de procentuele signaalverandering voor TIA en TID te vergelijken met de basislijn voor CueE en CueD. Gepaarde steekproef eenzijdige t-tests werden gebruikt om signaal verandering, nauwkeurigheid, en reactietijd verschillen tussen CueD en CueE (hypothese 1 en 2) te vergelijken.
Post hoc testen betroffen afzonderlijke t-tests voor elke ROI binnen elk netwerk. ROI-analyse werd Bonferroni gecorrigeerd als het netwerk omnibus test was niet significant. We presenteren ongecorrigeerde p-waarden en een commentaar waarin staat of deze p-waarde zou hebben overleefd Bonferroni correctie voor alle meervoudige vergelijkingen. SPSS 24 werd gebruikt voor alle statistische analyses.
Resultaten
Prestaties
De nauwkeurigheid voor de gemakkelijke stimuli (“StimE”) was 98% ± 1,2% SEM en voor de moeilijke stimuli (“StimD”) 85% ± 2,6%. De reactietijd voor StimE was 682 ± 20 ms en voor StimD 1.138 ± 27 ms. Beide condities vertonen voldoende nauwkeurigheidspercentages om er zeker van te zijn dat de taak werd uitgevoerd zoals geïnstrueerd door alle deelnemers. Zoals verondersteld reageerden de deelnemers minder accuraat (T = -4.3, p < 0.001) en trager (T = 17.8, p < 0.001) voor StimD dan voor StimE (figuur 3), wat aangeeft dat het contrast tussen de gemakkelijke en moeilijke stimuli succesvol was.
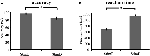
Figuur 3. Prestatie resultaten. (A) Nauwkeurigheid voor beide stimuluscategorieën, (B) reactietijd voor beide stimuluscategorieën. De foutbalkjes vertegenwoordigen de standaardfout van het gemiddelde (SEM). *p ≤ 0.001. Afkortingen: StimE, een cue die een makkelijke stimulus aangeeft, gevolgd door een makkelijke stimulus; StimD, een cue die een moeilijke stimulus aangeeft, gevolgd door een moeilijke stimulus.
Functionele MRI
Descriptives
Het TIA netwerk bestond uit 20 ROI’s, waarvan 10 gebaseerd waren op lokale maxima voor CueE, vijf gebaseerd waren op lokale maxima voor CueD, en vijf zowel een CueE als een CueD maximum bevatten (tabel 1). Van deze 20 ROI’s, 19 vertoonden significante activiteit ten opzichte van de basislijn voor CueE, 18 voor CueD (tabel 1). De gemiddelde signaal verandering in TIA in vergelijking met de basislijn voor CueE was 0,12 ± 0,02 (t = 6,11, p < 0,001) en voor CueD 0,12 ± 0,02 (t = 7,61, p < 0,001).
Het TID netwerk bestond uit 11 ROI’s, waarvan er drie gebaseerd waren op lokale maxima voor CueE, zes gebaseerd waren op lokale maxima voor CueD, en twee zowel een CueE als een CueD maximum bevatten (tabel 1). Van deze 11 ROI’s, vier weergegeven significante activiteit ten opzichte van de basislijn voor CueE, 10 voor CueD (tabel 1). De gemiddelde signaal verandering in TID ten opzichte van de basislijn voor CueE was -0,07 ± 0,02 (t = 2,68, p < 0,01), en voor CueD -0,12 ± 0,02 (t = 5,37, p < 0,001; Tabel 3).
Afstemming op de verwachte moeilijkheid
De signaaltoename in TIA was niet significant sterker voor CueD vergeleken met CueE (t = -0,24, p = 0,41) wat aangeeft dat het niveau van TIA-activatie niet is afgestemd op de verwachte moeilijkheid (figuur 4, tabel 3). Post hoc ROI analyse toonde geen van de 20 ROI’s binnen TIA met een significante signaal toename voor CueD in vergelijking met CueE na toepassing van Bonferroni correctie (Tabel 4, figuur 5).
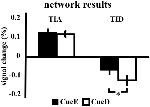
Figuur 4. Overzicht van de netwerkresultaten. Foutbalkjes vertegenwoordigen SEM. *p ≤ 0.05 voor cue moeilijk vs. cue gemakkelijk. Afkortingen: TIA, task induced activation network; TID, task induced deactivation network; CueE, een cue die een makkelijke stimulus aangeeft, niet gevolgd door een stimulus; CueD, een cue die een moeilijke stimulus aangeeft, niet gevolgd door een stimulus.
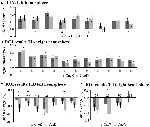
Figuur 5. Overzicht van individuele ROI reacties binnen de taak geïnduceerde activering netwerk, linker (A) en rechter hersenhelft (B), en taak geïnduceerde deactivering, linker (C), en rechter hersenhelft (D). Foutbalkjes vertegenwoordigen SEM. *p ≤ 0.05 voor CueD vs CueE, zie figuur 2 voor de locatie van de ROI’s, zie tabel 1 voor de namen, afkortingen, en MNI coördinaten van de ROI’s.
De signaal afname in TID was significant sterker voor CueD in vergelijking met CueE (T = -2.48, p = 0.01) wat aangeeft dat het niveau van TID is afgestemd op de verwachte moeilijkheidsgraad (tabel 3, figuur 4). Post hoc ROI analyse toonde vier van de 11 ROI’s van TID met een significante signaal afname voor CueD in vergelijking met CueE, namelijk LMPFG (T = -1.83, p = 0.04), LSPG (T = -2.32, p = 0.02), LSTG (T = -2.69, p < 0.01), en RCALC (T = -2.90, p < 0.01). Deze resultaten geven aan dat afstemming op de verwachte moeilijkheid het sterkst is in de linker frontale, temporale, en visuele ROI’s (Tabel 4, Figuur 5).
Discussie
In deze studie hebben we onderzocht of en hoe fasische alertheid is afgestemd op de verwachte moeilijkheid van een komende cognitieve uitdaging. Fasische alertheid werd weerspiegeld in zowel geactiveerde als gedeactiveerde hersengebieden. Het geactiveerde netwerk omvatte regio’s van het centrale executieve netwerk. Het gedeactiveerde netwerk omvatte regio’s van het DMN, evenals visuele cortices. Het niveau van deactivatie schaalde met de verwachte moeilijkheidsgraad van de komende stimulus, terwijl het niveau van activatie dat niet deed. Deze resultaten suggereren dat modulatie van fasische alertheid voornamelijk tot uiting komt in graded suppressie processen die irrelevant zijn voor de huidige taak (bijvoorbeeld cardio-vagale, auditieve, en visuele processen). Mogelijk gebeurde dit omdat deze processen zouden kunnen interfereren met komende cognitieve uitdagingen.
Vorige beeldvormingsstudies van fasische alertheid gebruikten één moeilijkheidsgraad, presenteerden alleen geactiveerde hersengebieden (Shulman et al., 1999; Sturm en Willmes, 2001; Thiel et al., 2004; Fan et al., 2005; Périn et al., 2010; Yanaka et al., 2010), of richtten zich alleen op activiteit in visuele cortex (Bartolucci en Smith, 2011). Deze studies hebben een meestal rechts gelateraliseerd fronto-pariëtaal-thalamisch netwerk geïdentificeerd, soms gecombineerd met motorische en visuele corticale gebieden, dat geactiveerd werd door een cue. Er zijn aanzienlijke verschillen in de geactiveerde netwerken tussen de studies. Sommige van de verschillen tussen de netwerken in eerdere studies kunnen verklaard worden door de taak die volgde op de cue. Bijvoorbeeld, Thiel et al. (2004) identificeerden alleen activatie in visuele corticale gebieden met behulp van een visuele perceptie taak, terwijl Fan et al. (2005) en Yanaka et al. (2010) thalamische en motorische activatie identificeerden met een motorische respons taak. Hoewel Bartolucci en Smith (2011) een elegant cued taakontwerp presenteren met vier moeilijkheidsgraden van een oriëntatie discriminatietaak, presenteerden zij alleen activatie in de visuele cortex. Daarom is het onduidelijk hoe andere hersengebieden reageerden in deze taak. Het taak-geïnduceerde activeringsnetwerk, geïdentificeerd in de huidige studie lijkt het meest op het netwerk gevonden door Shulman et al. (1999), die een vergelijkbaar type visuele verwerkingstaak gebruikten.
Het is onduidelijk of fasische alertheid een bottom-up of top-down reactie is op een niet-informatieve cue (Thiel et al., 2004; Hackley, 2009; Périn et al., 2010; Bartolucci en Smith, 2011; Chica et al., 2016). Fasische alertheid is door sommigen beschouwd als een bottom-up (Sturm et al., 1999; Hackley, 2009), door anderen als top-down (Bartolucci en Smith, 2011), en door weer anderen als een combinatie (Thiel et al., 2004; Périn et al., 2010) respons. Wij stellen dat het het meest geschikt is om de hersenrespons op een cue te bestempelen als een combinatie van bottom-up en top-down verwerking, omdat deelnemers zowel reageren op een externe cue als op een instructie die bij deze cue hoort. Onze belangrijkste resultaten betreffen echter het verschil in respons op twee vergelijkbare cues die een verschillend type taakstimulus aanduiden. Daarom stellen wij dat het resulterende verschil tussen de cue die een moeilijke taak aangeeft en de cue die een gemakkelijke taak aangeeft, een niveau van top-down controle kan vertegenwoordigen dat verband houdt met de interpretatie van de cue en de bijbehorende instructie.
Het taakgeïnduceerde deactiveringsnetwerk omvatte hersengebieden van de DMN, namelijk de mediale prefrontale gyrus, superieure temporale gyri, en angulaire gyri (Shulman et al., 1999; Raichle et al., 2001; Raichle, 2015). Er wordt algemeen verondersteld dat DMN deactivering de taakprestatie bevordert door het verminderen van interne processen die interfereren met cognitieve uitdagingen (Raichle et al., 2001; Buckner et al., 2008; Raichle, 2015). Deze visie wordt ondersteund door studies die aantonen dat de mate van DMN deactivatie schaalt met de moeilijkheid van een taak tijdens taakuitvoering (McKiernan et al., 2003; Singh and Fawcett, 2008). Deze studies onderzochten de deactivering tijdens taakuitvoering. Onze resultaten suggereren dat deze schaling al kan optreden tijdens de taak anticipatie fase. Weissman et al. (2006) onderzochten de variabiliteit in individuele reactietijden om aandachtsverliezen te identificeren. De aandachtsverliezen zouden geassocieerd kunnen worden met verminderde DMN deactivatie. Terwijl (Weissman et al., 2006) keken naar natuurlijke variatie in het niveau van alertheid, geven onze resultaten aan dat de deactivering in verschillende DMN regio’s ook kan worden afgestemd op een top-down manier voordat de taakstimulus wordt gepresenteerd.
De meest ingrijpende afstemmingseffecten werden gevonden in de linker mediale prefrontale, temporale en visuele regio’s. Hieronder bespreken we mogelijke implicaties van deze effecten voor deze regio’s in relatie tot hun voorgestelde functie.
De mediale prefrontale cortex activiteit is eerder in verband gebracht met mind-wandering (Bertossi et al., 2017), memory retrieval (Euston et al., 2012), en cardiovagale controle (Wong et al., 2007). Deze mediale prefrontale deactivatie suggereert dat een van deze functies al wordt onderdrukt in afwachting van een cognitieve uitdaging.
De afstemming van deactivatie op de verwachte moeilijkheid in visuele en temporele regio’s kan verband houden met onderdrukking van irrelevante visuele en auditieve zintuiglijke input. De afstemming in de bilaterale temporale regio’s kan specifiek worden gerelateerd aan onderdrukking van de ruis gegenereerd door de MRI-scanner. Het is redelijk te verwachten dat het geluidsniveau vergelijkbaar is tussen de condities. Het feit dat het niveau van deactivatie sterker is voor de moeilijke cues suggereert dat de verwerking van omgevingsgeluid sterker onderdrukt wordt als een moeilijke taak verwacht wordt. Deactivatie in visuele cortices wordt minder vaak gerapporteerd dan deactivatie in de temporele regio’s. Smith et al. (2000) hebben echter eerder een associatie gerapporteerd tussen wijdverspreide deactivatie in de visuele cortex en aandacht voor een specifiek deel van een plaatje. Giesbrecht et al. (2006) rapporteerden ook modulatie van visuele activatie geassocieerd met heimelijke aandacht voor objecten dichtbij het centrum van hun gezichtsveld vergeleken met objecten in het perifere gezichtsveld. Deze bevindingen geven aan dat de activatie in de visuele cortex gemoduleerd kan worden door heimelijke aandacht voor zowel foveale als perifere gebieden. Onze studie voegt een nieuwe dimensie toe aan deze bevindingen, omdat het suggereert dat de activatie in de visuele cortex niet alleen gemoduleerd wordt door de locatie van heimelijke visuele aandacht, maar ook door de verwachte moeilijkheidsgraad van een visuele uitdaging; en omdat de cues identiek waren in locatie en grootte lijkt dit proces top-down gereguleerd te worden.
We identificeerden ook een set hersengebieden die verhoogde activatie vertoonden in afwachting van een cognitieve uitdaging. Dit netwerk vertoonde gelijkenis met het centrale executieve netwerk dat eerder in verband is gebracht met de uitvoering van werkgeheugentaken (Lawrence et al., 2003). Echter, de activatie in dit netwerk was niet afgestemd op de verwachte taak moeilijkheid. Dit suggereert dat deze regio’s processen vertegenwoordigen die vergelijkbaar zijn voor de moeilijke en makkelijke conditie. Mogelijk is de activiteit in dit netwerk geassocieerd met de evaluatie van de cue, of het ophalen en onderhouden van de taakcontext en instructies.
Er moet rekening worden gehouden met enkele beperkingen die de interpretatie van onze resultaten kunnen beïnvloeden. Ten eerste, we hebben geen proeven opgenomen met stimuli die niet werden voorafgegaan door een cue, daarom is het niet mogelijk om het effect van de cue op cognitieve prestaties te onderzoeken. Door tijdsbeperking was het niet mogelijk om onze taak te herhalen met identieke stimuli maar zonder cues.
Ten tweede gebruikten we een uitroepteken als onderdeel van de cue die een moeilijke cognitieve uitdaging aangeeft, omdat dit symbool typisch wordt gebruikt als er een behoefte is aan verhoogde alertheid. Het is mogelijk dat het uitroepteken zelf een rol heeft gespeeld in de verschillende activeringspatronen voor de gemakkelijke en moeilijke conditie, vanwege de inherente betekenis ervan. Dit heeft echter geen invloed op de hoofdinterpretatie van onze resultaten, behalve dat onze hoofdresultaten geclassificeerd kunnen worden als een bottom-up respons in plaats van een top-down respons. Tenslotte laat onze experimentele opzet ons niet toe te onderzoeken of de activiteit gerelateerd aan fasische alertheid gegeneraliseerd kan worden naar andere domeinen, of dat het domeinspecifiek is, aangezien het alleen een visuo-perceptuele cognitieve uitdaging omvatte.
Tot slot, in deze studie hebben we aangetoond dat de afstemming van fasische alertheid wordt weergegeven door het niveau van deactivatie in verschillende regio’s. Dit effect is het sterkst in de mediale prefrontale, visuele en temporale cortex, wat een weerspiegeling kan zijn van onderdrukking van cardiovagale controle, visuele verwerking in het perifere gezichtsveld, en onderdrukking van ruis van de MRI-scanner. Deze resultaten suggereren dat cognitieve prestaties worden vergemakkelijkt door een toestand van de hersenen die nauw gekoppeld is aan verwachtingen over de moeilijkheid van een komende cognitieve uitdaging.
Beschikbaarheid van gegevens
Ruwe gegevens werden gegenereerd in het Elisabeth-Tweesteden ziekenhuis. Afgeleide gegevens die de bevindingen van deze studie ondersteunen zijn op redelijk verzoek beschikbaar bij de corresponderende auteur.
Ethische verklaring
Deze studie is uitgevoerd in overeenstemming met de aanbevelingen van de Wet Maatschappelijke Ondersteuning, Medisch Ethische Commissie Brabant. Alle proefpersonen gaven schriftelijke geïnformeerde toestemming in overeenstemming met de Verklaring van Helsinki. Het protocol werd goedgekeurd door de medisch ethische commissie Brabant.
Author Contributions
MD en JJ schreven het hoofdmanuscript en bereidden de figuren voor. MD en IS voerden de experimenten uit. G-JR, NR, en JJ hielden gezamenlijk toezicht op het werk. Alle auteurs beoordeelden het manuscript.
Funding
Deze studie werd gefinancierd door ZonMW, een Nederlandse nationale organisatie (Nederlandse Organisatie voor Gezondheidsonderzoek en Ontwikkeling, ZONMW; Projectnummer: 842003004), projecttitel: Clinical implementation of advanced MRI techniques for localization and monitoring of sensorimotor and cognitive functions in patients with brain tumors.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek is uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
Wij willen de radiografen William Pigmans en Maikel Brands bedanken voor hun bijdrage aan deze studie.
Afkortingen
DMN, default mode network; M, man; F, vrouw; GLM, algemeen lineair model; SPM, statistical parametric mapping; CueE, een cue die een gemakkelijke stimulus aangeeft, niet gevolgd door een stimulus; CueD, een cue die een moeilijke stimulus aangeeft, niet gevolgd door een stimulus; StimE, een cue die een gemakkelijke stimulus aangeeft, gevolgd door een gemakkelijke stimulus; StimD, een cue die een moeilijke stimulus aangeeft, gevolgd door een moeilijke stimulus; MRI, magnetic resonance imaging; ROI, region of interest; GDL, GNU data language; TIA, task induced activation network; TID, task induced deactivation network; SEM, standaardfout van het gemiddelde.
Footnotes
- ^ https://www.zonmw.nl/nl/onderzoek-resultaten/kwaliteit-van-zorg/programmas/project-detail/topzorg/clinical-implementation-of-advanced-mri-techniques-for-localization-and-monitoring-of-sensorimotor-a/verslagen/
- ^ http://www.fil.ion.ucl.ac.uk/spm/software/spm12/
- ^ https://github.com/gnudatalanguage/gdl
Bartolucci, M., en Smith, A. T. (2011). Attentional modulation in visual cortex is modified during perceptual learning. Neuropsychologia 49, 3898-3907. doi: 10.1016/j.neuropsychologia.2011.10.007
PubMed Abstract | CrossRef Full Text | Google Scholar
Bertossi, E., Peccenini, L., Solmi, A., Avenanti, A., and Ciaramelli, E. (2017). Transcraniële gelijkstroomstimulatie van de mediale prefrontale cortex dempt mind-wandering bij mannen. Sci. Rep. 7:16962. doi: 10.1038/s41598-017-17267-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Buckner, R. L., Andrews-Hanna, J. R., and Schacter, D. L. (2008). The brain’s default network: anatomy, function and relevance to disease. Ann. N Y Acad. Sci. 1124, 1-38. doi: 10.1196/annals.1440.011
PubMed Abstract | CrossRef Full Text | Google Scholar
Buracas, G. T., and Boynton, G. M. (2002). Efficient design of event-related fMRI experiments using M-sequences. Neuroimage 16, 801-813. doi: 10.1006/nimg.2002.1116
PubMed Abstract | CrossRef Full Text | Google Scholar
Čeko, M., Gracely, J. L., Fitzcharles, M. A., Seminowicz, D. A., Schweinhardt, P., and Bushnell, M. C. (2015). Is een responsief default mode netwerk nodig voor succesvolle werkgeheugentaakprestatie? J. Neurosci. 35, 11595-11605. doi: 10.1523/JNEUROSCI.0264-15.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Chica, A. B., Bayle, D. J., Botta, F., Bartolomeo, P., and Paz-Alonso, P. M. (2016). Interacties tussen fasische alertheid en bewustzijn in het fronto-striatale netwerk. Sci. Rep. 6:13. doi: 10.1038/srep31868
PubMed Abstract | CrossRef Full Text | Google Scholar
Desmond, J. E., and Glover, G. H. (2002). Estimating sample size in functional MRI (fMRI) neuroimaging studies: statistical power analyses. J. Neurosci. Methods 118, 115-128. doi: 10.1016/s0165-0270(02)00121-8
PubMed Abstract | CrossRef Full Text | Google Scholar
Euston, D. R., Gruber, A. J., and McNaughton, B. L. (2012). The role of medial prefrontal cortex in memory and decision making. Neuron 76, 1057-1070. doi: 10.1016/j.neuron.2012.12.002
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Fossella, J., Flombaum, J. I., and Posner, M. I. (2005). De activering van aandachtsnetwerken. Neuroimage 26, 471-479. doi: 10.1016/j.neuroimage.2005.02.004
PubMed Abstract | CrossRef Full Text | Google Scholar
Fan, J., McCandliss, B. D., Sommer, T., Raz, A., and Posner, M. I. (2002). Het testen van de efficiëntie en onafhankelijkheid van aandachtsnetwerken. J. Cogn. Neurosci. 14, 340-347. doi: 10.1162/089892902317361886
PubMed Abstract | CrossRef Full Text | Google Scholar
Giesbrecht, B., Weissman, D. H., Woldorff, M. G., and Mangun, G. R. (2006). Pre-target activity in visual cortex predicts behavioral performance on spatial and feature attention tasks. Brain Res. 1080, 63-72. doi: 10.1016/j.brainres.2005.09.068
PubMed Abstract | CrossRef Full Text | Google Scholar
Hackley, S. A. (2009). De versnelling van de vrijwillige reactie door een waarschuwingssignaal. Psychophysiology 46, 225-233. doi: 10.1111/j.1469-8986.2008.00716.x
PubMed Abstract | CrossRef Full Text | Google Scholar
Härmä, M., Partinen, M., Repo, R., Sorsa, M., and Siivonen, P. (2008). Effecten van 6/6 en 4/8 wachtsystemen op slaperigheid bij brugofficieren. Chronobiol. Int. 25, 413-423. doi: 10.1080/074205802106769
PubMed Abstract | CrossRef Full Text | Google Scholar
Hedden, T., Van Dijk, K. R., Shire, E. H., Sperling, R. A., Johnson, K. A., and Buckner, R. L. (2012). Failure to modulate attentional control in advanced aging linked to white matter pathology. Cereb. Cortex 22, 1038-1051. doi: 10.1093/cercor/bhr172
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., Ramsey, N. F., de Zwart, J. A., van Gelderen, P., and Duyn, J. H. (2007). fMRI study of effort and information processing in a working memory task. Hum. Brain Mapp. 27, 431-440. doi: 10.1002/hbm.20297
PubMed Abstract | CrossRef Full Text | Google Scholar
Jansma, J. M., and Rutten, G. J. (2017). “A proposal for a system that facilitates quantitative replication of fMRI studies,” in Proceedings of the Human Brain Mapping Conference 2017 June 25-29, Vancouver, Canada. Online beschikbaar op: https://archive.aievolution.com/2017/hbm1701/index.cfm?do=abs.viewAbs&abs=4047.
Google Scholar
Kriegeskorte, N., Simmons, W. K., Bellgowan, P. S., and Baker, C. I. (2009). Circulaire analyse in systeemneurowetenschappen: de gevaren van dubbel dippen. Nat. Neurosci. 12, 535-540. doi: 10.1038/nn.2303
PubMed Abstract | CrossRef Full Text | Google Scholar
Kusnir, F., Chica, A. B., Mitsumasu, M. A., and Bartolomeo, P. (2011). Phasic auditieve alerting verbetert visuele bewuste waarneming. Bewustzijn. Cogn. 20, 1201-1210. doi: 10.1016/j.concog.2011.01.012
PubMed Abstract | CrossRef Full Text | Google Scholar
Lawrence, M. A., Ross, T. J., Hoffmann, H. G., and Stein, E. S. (2003). Multiple neural networks mediate sustained attention. J. Cogn. Neurosci. 15, 1028-1038. doi: 10.1162/089892903770007416
PubMed Abstract | CrossRef Full Text | Google Scholar
Liu, G., Sobering, G., Duyn, J., and Moonen, C. T. (1993). Een functionele MRI techniek die principes van echo-verschuiving combineert met een trein van waarnemingen (PRESTO). Magn. Reson. Med. 30, 764-768. doi: 10.1002/mrm.1910300617
PubMed Abstract | CrossRef Full Text | Google Scholar
Macleod, J. W., Lawrence, M. A., McConnell, M. M., Eskes, G. A., Klein, R. M., and Shore, D. I. (2010). Appraising the ANT: psychometrische en theoretische overwegingen van de aandachtsnetwerktest. Neuropsychology 24, 637-651. doi: 10.1037/a0019803
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., D’Angelo, B. R. D., Kaufman, J. N., and Binder, J. R. (2006). Het onderbreken van de “stroom van bewustzijn”: een fMRI onderzoek. Neuroimage 29, 1185-1191. doi: 10.1016/j.neuroimage.2005.09.030
PubMed Abstract | CrossRef Full Text | Google Scholar
McKiernan, K. A., Kaufman, J. N., Kucera-Thompson, J. K., and Binder, J. R. (2003). Een parametrische manipulatie van factoren die taak-geïnduceerde deactivatie beïnvloeden in functionele neuroimaging. J. Cogn. Neurosci. 15, 394-408. doi: 10.1162/089892903321593117
PubMed Abstract | CrossRef Full Text | Google Scholar
Nebes, R. D., and Brady, C. B. (1993). Fasische en tonische alertheid bij de ziekte van Alzheimer. Cortex 29, 77-90. doi: 10.1016/s0010-9452(13)80213-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Neggers, S. F., Hermans, E. J., and Ramsey, N. F. (2008). Verbeterde gevoeligheid met snelle driedimensionale bloed-zuurstof-niveau-afhankelijke functionele MRI: vergelijking van SENSE-PRESTO en 2D-EPI bij 3 T. NMR Biomed. 21, 663-676. doi: 10.1002/nbm.1235
PubMed Abstract | CrossRef Full Text | Google Scholar
Périn, B., Godefroy, O., Fall, S., and de Marco, G. (2010). Alertness in young healthy subjects: an fMRI study of brain region interactivity enhanced by a warning signal. Brain Cogn. 72, 271-281. doi: 10.1016/j.bandc.2009.09.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Pyka, M., Beckmann, C. F., Schöning, S., Hauke, S., Heider, D., Kugel, H., et al. (2009). Impact of working memory load on FMRI resting state pattern in subsequent resting phases. PLoS One 4:e7198. doi: 10.1371/journal.pone.0007198
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E. (2015). Het default mode netwerk van de hersenen. Annu. Rev. Neurosci. 38, 433-447. doi: 10.1146/annurev-neuro-071013-014030
PubMed Abstract | CrossRef Full Text | Google Scholar
Raichle, M. E., MacLeod, J. W., Snyder, A. Z., Powers, W. J., Gusnard, D. A., and Shulman, G. L. (2001). Een standaard modus van hersenfunctie. Proc. Natl. Acad. Sci. U S A 98, 676-682. doi: 10.1073/pnas.98.2.676
PubMed Abstract | CrossRef Full Text | Google Scholar
Shulman, G. L., Ollinger, J. M., Akbudak, E., Conturo, T. E., Snyder, A. Z., Petersen, S. E., et al. (1999). Areas involved in encoding and applying directional expectations to moving objects. J. Neurosci. 19, 9480-9496. doi: 10.1523/jneurosci.19-21-09480.1999
PubMed Abstract | CrossRef Full Text | Google Scholar
Singh, K. D., and Fawcett, I. P. (2008). Transient and linearly graded deactivation of the human default-mode network by a visual detection task. Neuroimage 41, 100-112. doi: 10.1016/j.neuroimage.2008.01.051
PubMed Abstract | CrossRef Full Text | Google Scholar
Smith, A. T., Singh, K. D., and Greenlee, M. W. (2000). Aandachtsonderdrukking van activiteit in de menselijke visuele cortex. Neuroreport 11, 271-277. doi: 10.1097/00001756-200002070-00010
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., de Simone, A., Krause, B. J., Specht, K., Hessemann, V., Radermacher, I., et al. (1999). Functional anatomy of intrinsic alertness: evidence for a froto-parietal-thalamic-brainstem network in the right hemisphere. Neuropsychologia 37, 797-805. doi: 10.1016/s0028-3932(98)00141-9
PubMed Abstract | CrossRef Full Text | Google Scholar
Sturm, W., and Willmes, K. (2001). Over de functionele neuroanatomie van intrinsieke en fasische alertheid. Neuroimage 14, S76-S84. doi: 10.1006/nimg.2001.0839
PubMed Abstract | CrossRef Full Text | Google Scholar
Thiel, C. M., Zilles, K., and Fink, G. R. (2004). Cerebral correlates of alerting, orienting and reorienting of visuospatial attention: an event-related fMRI study. Neuroimage 21, 318-328. doi: 10.1016/j.neuroimage.2003.08.044
PubMed Abstract | CrossRef Full Text | Google Scholar
Tzourio-Mazoyer, N., Landeau, B., Papathanassiou, D., Crivello, F., Etard, O., Delcroix, N., et al. (2002). Automated anatomical labeling of activations in SPM using a macroscopic anatomical parcellation of the MNI MRI single-subject brain. Neuroimage 15, 273-289. doi: 10.1006/nimg.2001.0978
PubMed Abstract | CrossRef Full Text | Google Scholar
van Gelderen, P., Ramsey, N. F., Liu, G., Duyn, J. H., Frank, J. A., Weinberger, D. R., et al. (1995). Drie-dimensionale functionele magnetische resonantie beeldvorming van de menselijke hersenen op een klinische 1.5-T scanner. Proc. Natl. Acad. Sci. U S A 92, 6906-6910. doi: 10.1073/pnas.92.15.6906
PubMed Abstract | CrossRef Full Text | Google Scholar
Weinbach, N., and Henik, A. (2011). Fasische alertheid kan executieve controle moduleren door globale verwerking van visuele stimuli te verbeteren. Cognition 121, 454-458. doi: 10.1016/j.cognition.2011.08.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Weissman, D. H., Roberts, K. C., Visscher, K. M., and Woldorff, M. G. (2006). The neural bases of momentary lapses in attention. Nat. Neurosci. 9, 971-978. doi: 10.1038/nn1727
PubMed Abstract | CrossRef Full Text | Google Scholar
Wong, S. W., Massé, N., Kimmerly, D. S., Menon, R. S., and Shoemaker, J. K. (2007). Ventral medial prefrontal cortex and cardiovagal control in conscious humans. Neuroimage 35, 698-708. doi: 10.1016/j.neuroimage.2006.12.027
PubMed Abstract | CrossRef Full Text | Google Scholar
Yanaka, H. T., Saito, D. N., Uchiyama, Y., and Sadato, N. (2010). Neurale substraten van fasische alertheid: een functionele magnetische resonantie imaging studie. Neurosci. Res. 68, 51-58. doi: 10.1016/j.neures.2010.05.005
PubMed Abstract | CrossRef Full Text | Google Scholar