Når vi nærmer os den højre side af det periodiske system, bliver lighederne mellem grundstofferne inden for en gruppe større igen. Dette er tilfældet for gruppe VIA. Bortset fra polonium, som er radioaktivt og normalt udelades fra diskussionen, danner alle medlemmer af gruppen X2- ioner, når de kombineres med stærkt elektropositive metaller. Tendensen til at blive reduceret til oxidationstrin -2 aftager dog betydeligt fra top til bund i gruppen, og tellur viser nogle metalliske egenskaber. VIA-elementerne i gruppen kaldes chalcogener, fordi de fleste kobbermalme (græsk chalkos) er oxider eller sulfider, og sådanne malme indeholder spor af selen og tellur. De atomare egenskaber for chalcogenerne er opsummeret i tabellen.
| Element | Symbol | Elektronkonfiguration | Usuelle oxidation State | Radius/pm | ||||
|---|---|---|---|---|---|---|---|---|
| Kovalent | Ionisk (X2-) | |||||||
| Oxygen | O | 2s22p4 | -2 | 66 | 140 | |||
| Sulfur | S | 3s23p4 | +6, +4, -2 | 104 | 184 | |||
| Selen | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 | |||
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 | |||
| Symbol | Ioniseringsenergi/MJ mol-1 | Densitet/ g cm-3 | Elektro- negativitet | Smeltepunkt (i °C) | |||||
|---|---|---|---|---|---|---|---|---|---|
| Første | Decond | Third | |||||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 | |||
| S | 1.006 | 2.257 | 3.367 | 3.367 | 2.06 | 2.5 | 119 | ||
| Se | 0.947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 | |||
| Te | 0.876 | 1.800 | 2.800 | 2.704 | 6,25 | 2,1 | 450 | ||
Ved almindelige temperaturer og tryk er ilt en gas. Det findes i en af de to allotrope former: O2, som udgør 21 procent af jordens atmosfære, eller O3 (ozon), som langsomt nedbrydes til O2. O3 kan fremstilles ved at lade en elektrisk udladning passere gennem O2 eller luft:
\
Denne reaktion forekommer naturligt som følge af lynnedslag. O3 dannes også af enhver anordning, der frembringer elektriske gnister. Du har måske bemærket den karakteristiske lugt i nærheden af f.eks. en elektrisk motor.
Ozon dannes i jordens stratosfære (mellem 10 og 50 km højde) af ultraviolette stråler, hvis bølgelængder er kortere end 250 nm:
Ozon absorberer selv ultraviolet stråling med længere bølgelængder (op til 340 nm), hvilket forhindrer disse skadelige stråler i at nå jordens overflade. Ellers ville disse stråler øge forekomsten af hudkræft hos mennesker og forårsage andre miljøproblemer. I de senere år er der fremkommet overbevisende beviser for, at nitrogenoxidemissioner fra fly med supersonisk transport (SST-fly) (som flyver i stratosfæren) kan reducere koncentrationen af ozon. Lignende konklusioner er blevet draget med hensyn til chlorfluorcarboner (undertiden kaldet CFC’er), der anvendes som drivmiddel i aerosolhårspray og deodoranter. Når CFC’erne først er kommet ud i atmosfæren, sker der en fotokemisk reaktion, som medfører, at atomært klor bliver spaltet af fra CFC’erne. Dette atomklor kan derefter deltage i en katalytisk ozonnedbrydende reaktion:
\
\
Atomklor regenereres, hvilket betyder, at hvert enkelt CFC-molekyle har potentiale til at nedbryde store mængder ozon. I 1980’erne blev det fastslået, at brugen af kemikalier som CFC’er var med til at udtynde stratosfærisk ozon. Det var også på dette tidspunkt, at “ozonhullet” over Antarktis blev opdaget. Som reaktion på nedbrydningen af ozonlaget og den fare, som den udgør, blev Montreal-protokollen om stoffer, der nedbryder ozonlaget, underskrevet af ledere fra flere lande med det formål at udfase produktion og brug af CFC’er og andre kemikalier, der er skadelige for ozonlaget. I dag har 191 lande underskrevet protokollen, og selv om det forventes at tage indtil 2075, før ozonniveauet vender tilbage til det normale niveau, har Montreal-protokollen indtil videre vist sig at være en succes.
O3 er også en vigtig bestanddel af fotokemisk smog. Det dannes, når O-atomer (dannet ved at bryde N-O-bindinger i NO2) reagerer med molekyler i henhold til Eq. \(\ref{3}\). O3 er et stærkere oxidationsmiddel end O2. Det reagerer med umættede kulbrinter (alkener) i inddampet benzin og danner aldehyder og ketoner, som er øjenirriterende. Gummi er et polymermateriale, som indeholder 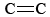 bindinger, og derfor reagerer det også med O3. Endvidere har ozon ved jordoverfladen og den ledsagende smog vist sig at være et betydeligt sundhedsproblem, da det irriterer og skader luftvejene og også har forbindelse til astma. Ozon er altså gavnligt i den øvre atmosfære, men har negative virkninger i jordoverfladen.
bindinger, og derfor reagerer det også med O3. Endvidere har ozon ved jordoverfladen og den ledsagende smog vist sig at være et betydeligt sundhedsproblem, da det irriterer og skader luftvejene og også har forbindelse til astma. Ozon er altså gavnligt i den øvre atmosfære, men har negative virkninger i jordoverfladen.
Svovl forekommer i en række allotropiske former. Ved stuetemperatur er den mest stabile form rhombisk svovl. Dette gule faste stof består af S8-molekyler (ses i Jmol nedenfor) pakket i et krystalgitter, der hører til det orthorhombiske system (anført på siden, der omhandler krystalsystemer).
Figur \(\PageIndex{1}\) S8-molekyle: Den oprindelige kugle- og pindemodel kan manipuleres i det tredimensionelle rum. Klik på VdW-radius for at se en rumudfyldende model af det samme molekyle.
Ved opvarmning til 96 °C ændres fast rhombisk svovl meget langsomt til monoklin svovl, hvor en tredjedel af S8-molekylerne er tilfældigt orienteret i krystalgitteret. Når begge former for svovl smelter, er væsken først lysegul og flyder let, men over 160°C bliver den mere og mere tyktflydende. Først i nærheden af kogepunktet på 444,6 °C bliver den igen tyndtflydende. Denne usædvanlige ændring i viskositeten med temperaturen tilskrives åbningen af den otte-ledede ring af S8 og dannelsen af lange kæder af svovlatomer. Disse er sammenfiltrede og forhindrer væsken i at flyde. Denne forklaring understøttes af, at hvis den viskose væske afkøles hurtigt ved at hælde den i vand, kan det eksperimentelt påvises, at det dannede amorfe svovl består af lange kæder af svovlatomer.
Både selen og tellur har faste strukturer, hvor atomerne er bundet i lange spiralformede kæder. Begge er halvledere, og den elektriske ledningsevne for selen afhænger af intensiteten af det lys, der falder på grundstoffet. Denne egenskab udnyttes i seleniumfotoceller, som ofte anvendes i fotografiske eksponeringsmålere.
Selenium anvendes også i ensrettere til at konvertere elektrisk vekselstrøm til jævnstrøm. Forbindelser af selen og tellur er af ringe kommerciel betydning, og de er ofte giftige. Desuden har mange af dem en ildelugtende lugt, optages af kroppen og afgives med sved og i åndedrættet. Disse egenskaber har hæmmet studiet af tellur- og selenforbindelser.
Kemiske reaktioner og forbindelser
Syre Da ilt har den næststørste elektronegativitet blandt alle grundstoffer, findes det i oxidationstilstanden -2 i de fleste forbindelser. Vigtige oxider er allerede blevet diskuteret i afsnittene om de grundstoffer, som de dannes af, og derfor vil vi her kun beskæftige os med usædvanlige oxidationstrin for oxygen. En af disse er +2-tilstanden, som findes i OF2, den mest almindelige forbindelse, hvor ilt er kombineret med det mere elektronegative fluor. Vi har allerede nævnt de -½- og -1-tilstande, der er observeret i alkalimetalsuperoxider og -peroxider, men en vigtig peroxid, hydrogenperoxid (H2O2), er endnu ikke blevet omtalt.
H2O2 kan fremstilles ved elektrolyse af opløsninger indeholdende sulfat-ioner. H2O2 er en svag syre, og det kan fungere som et oxidationsmiddel (ilt reduceres til -2-tilstanden) eller som et reduktionsmiddel (ilt oxideres til 0-tilstanden). Ligesom peroxidionen indeholder H2O2-molekylet en O-O enkeltbinding. Denne binding er ret svag sammenlignet med mange andre enkeltbindinger, og dette er medvirkende til H2O2’s reaktivitet. Forbindelsen nedbrydes let, især hvis den udsættes for lys eller er forurenet med spor af overgangsmetaller. Nedbrydningen
\kan ske eksplosivt i tilfælde af den rene væske. svovl Selv om dette grundstof kun forekommer i sekstendedele af jordens overflade, er det et af de få, der har været kendt og anvendt gennem historien. Aflejringer af elementært svovl er ikke ualmindelige, og fordi de var sten, der ville brænde, blev de oprindeligt kaldt svovlsten. Ved forbrænding af svovl dannes svovldioxid,
\
Denne farveløse gas har en kvælende lugt og er mere giftig end kulilte. Det er anhydridet af svovlsyre, en svag diprotisk syre:
SO2 dannes også, når næsten ethvert svovlholdigt stof forbrændes i luft. Kul indeholder f.eks. normalt mellem 1 og 4 % svovl, og ved forbrænding af kul frigives SO2 til atmosfæren. Mange metalmalme er sulfider, og når de opvarmes i luft, dannes der SO2. Kobber kan f.eks. fremstilles som grundstof ved opvarmning af kobber(I)sulfid:
\
Da SO2 er så giftigt, er dets frigivelse til atmosfæren et stort forureningsproblem. Når SO2 først er i luften, oxideres det langsomt til svovltrioxid, SO3:
Denne forbindelse er anhydridet af svovlsyre, H2SO4:
Så hvis luften forurenes med SO2 og SO3, kan der dannes en fin tåge af fortyndede dråber af. Alle tre stoffer er meget irriterende for hals og lunger og er ansvarlige for betydelige skader på menneskers sundhed.
Den naturlige mekanisme til fjernelse af svovloxider fra luften er opløsning i regndråber efterfulgt af udfældning. Dette gør regnvandet mere surt, end det ellers ville være, og sur regn er nu almindeligt i industrialiserede områder i USA og Europa. Surt regn kan langsomt opløse kalksten og marmor, som begge består af CaCO3:
\
Som følge heraf kan statuer og bygninger af disse materialer blive beskadiget.
Trods det faktum, at der frigives en enorm mængde svovl til miljøet ved forbrænding af kul og smeltning af malm, genvindes dette grundstof normalt ikke fra sådanne processer. I stedet udvindes det kommercielt fra store forekomster langs den amerikanske golfkyst og fra raffinering af sur petroleum. Sour petroleum indeholder mange svovlforbindelser, herunder H2S, der lugter som rådne æg. Forekomsterne af elementært svovl i Texas og Louisiana udvindes ved hjælp af Frasch-processen. Vand ved 170 °C pumpes ned i et rør for at smelte svovlet, og svovlet presses op til overfladen med komprimeret luft. Det meste H2S eller S8 fra disse kilder oxideres til SO2, passerer over en vanadiumkatalysator for at danne SO3 og opløses i vand for at danne H2SO4. I 2005 blev der anslået produceret 190 mia. kg H2SO4 i verden, hvilket gør H2SO4 til en af de vigtigste industrikemikalier. Omkring halvdelen anvendes i fosfatgødningsproduktionen.
Rent H2SO4 er en væske ved stuetemperatur og har en stor affinitet for H2O. Dette skyldes tilsyneladende reaktionen
\
Dannelsen af H3O+ frigør energi, og reaktionen er eksotermisk. Koncentreret H2SO4 består af 93 masseprocent H2SO4 og 7 masseprocent H2O, hvilket svarer til mere end dobbelt så mange H2SO4- som H2O-molekyler. Da mange H2SO4-molekyler stadig har protoner at afgive, har koncentreret H2SO4 også en stor affinitet for H2O. Det bruges ofte som tørremiddel og kan anvendes i kondensationsreaktioner, der afgiver H2O.
- “Montreal Protocol-One Page Factsheet”. Miljøbeskyttelsesagenturet. 6. september 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. “Statement on Health Effects of Air Pollution before the Senate Committee on Health, Education, Labor and Pensions, Subcommittee on Health” (erklæring om luftforureningens sundhedsvirkninger for Senatets udvalg for sundhed, uddannelse, arbejde og pensioner, underudvalg om sundhed). Department of Health and Human Services. 3. september 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh og Yoshio Inoguchi. “Svovlsyre”. SRI Consulting. Juli 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Medvirkende
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff og Adam Hahn.
.