Amint közeledünk a periódusos rendszer jobb oldala felé, a csoporton belüli elemek közötti hasonlóságok ismét nagyobbak lesznek. Ez igaz a VIA csoportra is. A polónium kivételével, amely radioaktív és általában kihagyják a tárgyalásból, a csoport minden tagja X2-iont képez, ha erősen elektro-pozitív fémekkel egyesül. A -2 oxidációs állapotba való redukcióra való hajlam azonban a csoport tetejétől a csoport alja felé haladva jelentősen csökken, és a tellúr némi fémes tulajdonságot mutat. A VIA csoportba tartozó elemeket kalcogéneknek nevezik, mivel a legtöbb rézérc (görögül chalkos) oxidok vagy szulfidok, és ezek az ércek nyomokban szelént és tellúrt tartalmaznak. A kalkogének atomi tulajdonságait a táblázat foglalja össze.
| Elem | Szimbólum | Elektronkonfiguráció | Szükséges oxidáció Állapot | Sugár/pm | ||
|---|---|---|---|---|---|---|
| Kovalens | Ion (X2-) | |||||
| Oxygen | O | 2s22p4 | -2 | 66 | 140 | |
| Sulfur | S | 3s23p4 | +6, +4, -2 | 104 | 184 | |
| Selenium | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 | |
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 | |
| Szimbólum | Ionizációs energia/MJ mol-1 | sűrűség/ g cm-3 | Elektrom- negativitás | olvadáspont (°C-ban) | ||
|---|---|---|---|---|---|---|
| első | Második | Harmadik | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2.257 | 3.367 | 2.06 | 2.5 | 119 |
| Se | 0.947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 |
| Te | 0.876 | 1.800 | 2.704 | 6,25 | 2,1 | 450 |
Hétköznapi hőmérsékleten és nyomáson az oxigén gáz. Két allotróp formában létezik: O2, amely a földi légkör 21 százalékát alkotja, vagy O3 (ózon), amely lassan bomlik O2-re. Az O3 előállítható, ha elektromos kisülést vezetünk át O2-n vagy levegőn:
\
Ez a reakció a természetben villámcsapások hatására jön létre. O3 keletkezik minden olyan eszközzel is, amely elektromos szikrákat hoz létre. Talán észrevetted már a jellegzetes szagát például egy elektromos motor közelében.
Az ózon a földi sztratoszférában (10 és 50 km magasság között) képződik az ultraibolya sugárzás hatására, amelynek hullámhossza rövidebb, mint 250 nm:
\
\
\
Az ózon maga elnyeli a hosszabb hullámhosszú ultraibolya sugárzást (340 nm-ig), megakadályozva, hogy ezek a káros sugarak elérjék a földfelszínt. Ellenkező esetben ezek a sugarak növelnék az emberi bőrrák előfordulását és más környezeti problémákat okoznának. Az elmúlt években meggyőző bizonyítékot szereztek arra, hogy a szuperszonikus repülőgépek (amelyek a sztratoszférában repülnek) nitrogén-oxid-kibocsátása csökkentheti az ózon koncentrációját. Hasonló következtetéseket vontak le az aeroszolos hajlakkokban és dezodorokban hajtógázként használt klórozott-fluorozott szénhidrogénekkel (néha CFC-ként hivatkoznak rájuk) kapcsolatban is. A légkörbe kerülve egy fotokémiai reakció hatására a CFC-kből atomos klór bomlik le. Ez az atomos klór ezután részt vehet egy katalitikus ózonlebontó reakcióban:
\
\
Az atomos klór regenerálódik, ami azt jelenti, hogy minden egyes CFC-molekula nagy mennyiségű ózon lebontására képes. Az 1980-as években megállapították, hogy az olyan vegyi anyagok, mint a CFC-k használata ritkítja a sztratoszféra ózonrétegét. Ekkor fedezték fel az Antarktisz feletti “ózonlyukat” is. Az ózonréteg kimerülésére és az általa jelentett veszélyre válaszul több ország vezetője aláírta az ózonréteget lebontó anyagokról szóló montreali jegyzőkönyvet, amelynek célja a CFC-k és más, az ózonréteget károsító vegyi anyagok gyártásának és használatának fokozatos beszüntetése volt. Mára 191 ország írta alá a jegyzőkönyvet, és bár az előrejelzések szerint 2075-ig tart, amíg az ózonszintek visszatérnek a normális szintre, a Montreali Jegyzőkönyv eddig sikeresnek bizonyult.
Az O3 a fotokémiai szmog fontos összetevője is. Akkor keletkezik, amikor az O-atomok (amelyek az NO2 N-O kötéseinek felbontásával jönnek létre) az egyenlet szerint reagálnak a molekulákkal. \(\ref{3}\). Az O3 erősebb oxidálószer, mint az O2. A párologtatott benzinben lévő telítetlen szénhidrogénekkel (alkénekkel) reagálva aldehideket és ketonokat hoz létre, amelyek szemirritáló hatásúak. A gumi egy polimer anyag, amely 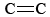 kötéseket tartalmaz, így ez is reagál az O3-mal. Továbbá a talajközeli ózon és a vele járó szmog jelentős egészségügyi problémának bizonyult, mivel irritálja és károsítja a légzőrendszert, és kapcsolatban áll az asztmával is. Tehát az ózon a felső légkörben jótékony hatású, de a talajszinten káros hatású.
kötéseket tartalmaz, így ez is reagál az O3-mal. Továbbá a talajközeli ózon és a vele járó szmog jelentős egészségügyi problémának bizonyult, mivel irritálja és károsítja a légzőrendszert, és kapcsolatban áll az asztmával is. Tehát az ózon a felső légkörben jótékony hatású, de a talajszinten káros hatású.
A kén számos allotróp formában fordul elő. Szobahőmérsékleten a legstabilabb forma a rombikus kén. Ez a sárga szilárd anyag S8 molekulákból áll (az alábbi Jmolban látható), amelyek az orthorhombikus rendszerhez tartozó kristályrácsba vannak csomagolva (a kristályrendszereket tárgyaló oldalon szerepel).
Ábra \(\PageIndex{1}\) S8 molekula: A kezdeti gömb és pálcika modell háromdimenziós térben manipulálható. A VdW-sugarakra kattintva ugyanennek a molekulának a térkitöltő modellje látható.
A 96°C-ra melegítve a szilárd rombikus kén nagyon lassan alakul át monoklin kénné, amelyben az S8 molekulák egyharmada véletlenszerűen orientálódik a kristályrácsban. A kén bármelyik formájának olvadásakor a folyadék először halványsárga színű és könnyen folyik, de 160°C felett egyre viszkózusabbá válik. Csak a 444,6°C-os forráspont közelében hígul fel újra. A viszkozitásnak ezt a szokatlan változását a hőmérséklet függvényében az S8 nyolctagú gyűrűjének megnyílásával és a kénatomok hosszú láncainak kialakulásával magyarázzák. Ezek egymásba fonódnak és megakadályozzák a folyadék áramlását. Ezt a magyarázatot támasztja alá az a tény, hogy ha a viszkózus folyadékot vízbe öntve gyorsan lehűtjük, a keletkező amorf kénről kísérletileg kimutatható, hogy hosszú kénatomláncokból áll.
Mind a szelén, mind a tellúr szilárd szerkezetű, amelyben az atomok hosszú spirális láncokba kapcsolódnak. Mindkettő félvezető, és a szelén elektromos vezetőképessége az elemre eső fény intenzitásától függ. Ezt a tulajdonságot használják ki a szelén fotocellákban, amelyeket gyakran használnak fényképészeti expozíciómérőkben.
A szelént egyenirányítókban is használják a váltakozó elektromos áram egyenárammá alakítására. A szelén és tellúr vegyületek kereskedelmi jelentősége csekély, és gyakran mérgezőek. Ráadásul sokuknak kellemetlen szaga van, a szervezet felveszi őket, és az izzadsággal és a lehelet útján távoznak. Ezek a tulajdonságok gátolták a tellúr- és szelénvegyületek tanulmányozását.
Kémiai reakciók és vegyületek
Az oxigén Mivel az oxigén az elemek közül a második legnagyobb elektronegativitással rendelkezik, a legtöbb vegyületben a -2 oxidációs állapotban található. A fontos oxidokat már tárgyaltuk azokkal az elemekkel foglalkozó fejezetekben, amelyekből keletkeznek, ezért itt csak az oxigén szokatlan oxidációs állapotaival foglalkozunk. Ezek egyike az OF2-ben található +2 oxidációs állapot, amely a leggyakoribb olyan vegyület, amelyben az oxigén az elektronegatívabb fluorral egyesül. Az alkálifém-szuperoxidokban és peroxidokban megfigyelhető -½ és -1 állapotokat már említettük, de egy fontos peroxidot, a hidrogén-peroxidot (H2O2) még nem tárgyaltuk.
A H2O2 szulfátionokat tartalmazó oldatok elektrolízisével állítható elő. A H2O2 gyenge sav, és oxidálószerként (az oxigén -2 állapotba redukálódik) vagy redukálószerként (az oxigén 0 állapotba oxidálódik) szolgálhat. A peroxidionhoz hasonlóan a H2O2 molekula is tartalmaz egy O-O egyszerű kötést. Ez a kötés sok más egyszerű kötéshez képest meglehetősen gyenge, és ez hozzájárul a H2O2 reaktivitásához. A vegyület könnyen bomlik, különösen, ha fénynek van kitéve vagy nyomokban átmeneti fémekkel szennyezett. A bomlás
\a tiszta folyadék esetében robbanásszerűen következhet be. kén Bár ez az elem csak a tizenhatodik helyen fordul elő a Föld felszínén, egyike azon keveseknek, amelyeket a történelem során ismertek és használtak. Az elemi kénből álló lerakódások nem ritkák, és mivel égő kövek voltak, eredetileg kénkőnek nevezték őket. A kén elégetésekor kén-dioxid keletkezik,
\
Ez a színtelen gáz fojtogató szagú és mérgezőbb, mint a szén-monoxid. Ez a kénsav anhidridje, egy gyenge diprotikus sav:
\
SO2 is keletkezik, ha szinte bármilyen kéntartalmú anyagot égetünk el levegőn. A szén például általában 1-4% ként tartalmaz, így a szén elégetésével SO2 kerül a légkörbe. Sok fémérc szulfid, és amikor ezeket levegőn melegítik, SO2 keletkezik. A réz például réz(I)-szulfid hevítésével nyerhető elemként:
\
Mivel az SO2 annyira mérgező, a légkörbe való kibocsátása jelentős szennyezési problémát jelent. A levegőbe kerülve az SO2 lassan oxidálódik kéntrioxiddá, SO3:
\
Ez a vegyület a kénsav, H2SO4:
\
anhidridje, így ha a levegő SO2-vel és SO3-mal szennyezett, híg cseppekből álló finom köd keletkezhet. Mindhárom anyag erősen irritálja a torkot és a tüdőt, és jelentős egészségkárosodásért felelős.
A kénoxidok levegőből való eltávolításának természetes mechanizmusa az esőcseppekben való oldódás, majd a kicsapódás. Ez az esővizet savasabbá teszi, mint amilyen egyébként lenne, és a savas eső ma már gyakori az Egyesült Államok és Európa iparosodott területein. A savas eső lassan feloldhatja a mészkövet és a márványt, amelyek mindkettő CaCO3-ból áll:
\
Így az ezekből az anyagokból készült szobrok és épületek károsodhatnak.
Dacára annak, hogy a szén elégetése és az ércek olvasztása során óriási mennyiségű kén kerül a környezetbe, ezt az elemet általában nem nyerik vissza az ilyen folyamatokból. Ehelyett az Egyesült Államok Öböl-menti nagy lelőhelyeiről és a savanyú kőolaj finomításából nyerik ki kereskedelmi forgalomban. A savanyú kőolaj számos kénvegyületet tartalmaz, köztük H2S-t, amelynek záptojásszaga van. A texasi és louisianai elemi kén lelőhelyeket a Frasch-eljárással bányásszák. A kén megolvasztásához 170 °C-os vizet pumpálnak egy csövön keresztül, majd a ként sűrített levegővel a felszínre préselik. Az ezekből a forrásokból nyert H2S vagy S8 nagy részét SO2-vé oxidálják, vanádium-katalizátoron átvezetve SO3-á alakítják, majd vízben feloldva H2SO4-é alakítják. 2005-ben a becslések szerint 190 milliárd kg H2SO4-et állítottak elő a világon, ami a H2SO4-ot az egyik legfontosabb ipari vegyi anyaggá teszi. Ennek mintegy felét a foszfáttartalmú műtrágyák előállításához használják fel.
A tiszta H2SO4 szobahőmérsékleten folyékony halmazállapotú, és nagy affinitással rendelkezik a H2O-hoz. Ez nyilvánvalóan a reakciónak köszönhető
\
A H3O+ képződése energiát szabadít fel, és a reakció exoterm. A tömény H2SO4 93%-ban H2SO4 és 7%-ban H2O tömegű, ami több mint kétszer annyi H2SO4 molekulának felel meg, mint H2O molekulának. Mivel sok H2SO4 molekulának még vannak leadandó protonjai, a tömény H2SO4-nek nagy az affinitása a H2O-hoz. Gyakran használják szárítószerként, és felhasználható olyan kondenzációs reakciókban, amelyekben H2O keletkezik.
- “Montreal Protocol-One Page Factsheet”. Környezetvédelmi Ügynökség. 2007. szeptember 6. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. “Nyilatkozat a légszennyezés egészségügyi hatásairól a Szenátus Egészségügyi, Oktatási, Munkaügyi és Nyugdíjügyi Bizottsága, Egészségügyi Albizottsága előtt. Egészségügyi és Emberi Szolgálatok Minisztériuma. 2003. szeptember 3. www.hhs.gov/asl/testify/t020903.html
- Bala Suresh és Yoshio Inoguchi. “Sulfuric Acid”. SRI Consulting. July 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Munkatársak
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, és Adam Hahn.
.