Kun lähestymme jaksollisen järjestelmän oikeaa reunaa, alkuaineiden yhtäläisyydet ryhmän sisällä kasvavat jälleen. Tämä pätee ryhmään VIA. Lukuun ottamatta poloniumia, joka on radioaktiivinen ja joka yleensä jätetään keskustelusta pois, kaikki ryhmän jäsenet muodostavat X2-ioneja, kun ne yhdistetään voimakkaasti sähköpositiivisten metallien kanssa. Taipumus pelkistyä hapetusasteeseen -2 vähenee kuitenkin huomattavasti ryhmän ylhäältä alaspäin, ja telluurilla on jonkin verran metallisia ominaisuuksia. Ryhmän VIA alkuaineita kutsutaan kalkogeeneiksi, koska useimmat kuparimalmit (kreikaksi kalkos) ovat oksideja tai sulfideja, ja tällaiset malmit sisältävät pieniä määriä seleeniä ja telluuria. Kalkogeenien atomiominaisuudet on koottu taulukkoon.
| Elementti | Symboli | Elektronikonfiguraatio | Usuaalinen hapettuminen State | Radius/pm | ||
|---|---|---|---|---|---|---|
| Kovalentti | Ioninen (X2-) | |||||
| Happi | O | 2s22p4 | -2 | 66 | 140 | |
| Happi | S | 3s23p4 | +6, +4, -2 | 104 | 184 | |
| Selenium | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 | |
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 | |
| Symboli | Ionisaatioenergia/MJ mol-1 | Tiheys/ g cm-3 | Electro- negatiivisuus | Sulamispiste (°C) | ||
|---|---|---|---|---|---|---|
| Ensimmäinen | Toinen | Kolmas | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2.257 | 3.367 | 2.06 | 2.5 | 119 |
| Se | 0.947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 |
| Te | 0.876 | 1.800 | 2.704 | 6.25 | 2.1 | 450 |
Tavallisissa lämpötiloissa ja paineissa happi on kaasu. Se esiintyy jommassakummassa kahdesta allotrooppisesta muodosta: O2, joka muodostaa 21 prosenttia maapallon ilmakehästä, tai O3 (otsoni), joka hajoaa hitaasti O2:ksi. O3:a voidaan valmistaa johtamalla sähköpurkaus O2:n tai ilman läpi:
\
Tämä reaktio tapahtuu luonnollisesti salamaniskujen seurauksena. O3:a syntyy myös missä tahansa laitteessa, joka tuottaa sähkökipinöitä. Olet ehkä huomannut sen tunnusomaisen hajun esimerkiksi sähkömoottorin läheisyydessä.
Ozon muodostuu maapallon stratosfäärissä (10-50 km:n korkeudella) ultraviolettisäteistä, joiden aallonpituus on alle 250 nm:n:
\
\
Otsoni itsessään imee itseensä pidemmän aallonpituuden omaavaa ultraviolettisäteilyä (340 nm:n säteilyyn asti) estäen siten haitallisten säteilylähteiden pääsyn maan pinnalle. Muuten nämä säteet lisäisivät ihmisten ihosyövän esiintyvyyttä ja aiheuttaisivat muita ympäristöongelmia. Viime vuosina on saatu vakuuttavia todisteita siitä, että yliäänilentokoneiden (jotka lentävät stratosfäärissä) typenoksidipäästöt voivat vähentää otsonipitoisuutta. Samanlaisia johtopäätöksiä on tehty kloorifluorihiilivedyistä (joita joskus kutsutaan CFC-yhdisteiksi), joita käytetään aerosolihiuslakkausten ja deodoranttien ponneaineina. Ilmakehään päästyään fotokemiallinen reaktio saa atomikloorin irtoamaan CFC-yhdisteistä. Tämä atomikloori voi sitten osallistua katalyyttiseen otsonia heikentävään reaktioon:
\
\
Atomikloori regeneroituu, mikä tarkoittaa, että jokainen CFC-molekyyli voi heikentää suuria määriä otsonia. 1980-luvulla todettiin, että CFC-yhdisteiden kaltaisten kemikaalien käyttö ohentaa stratosfäärin otsonia. Tällöin havaittiin myös Etelämantereen yläpuolella oleva otsoniaukko. Vastauksena otsonikatoon ja sen aiheuttamaan vaaraan useiden maiden johtajat allekirjoittivat otsonikerrosta heikentäviä aineita koskevan Montrealin pöytäkirjan, jonka tavoitteena on lopettaa vähitellen CFC-yhdisteiden ja muiden otsonikerrosta heikentävien kemikaalien tuotanto ja käyttö. Nykyään 191 maata on allekirjoittanut pöytäkirjan, ja vaikka otsonitasojen ennustetaan palautuvan normaaliksi vasta vuonna 2075, Montrealin pöytäkirja on toistaiseksi osoittautunut menestykseksi.
O3 on myös tärkeä osa valokemiallista savusumua. Sitä syntyy, kun O-atomit (jotka muodostuvat NO2:n N-O-sidosten rikkoutumisesta) reagoivat molekyylien kanssa yhtälön mukaisesti. \(\ref{3}\). O3 on voimakkaampi hapetin kuin O2. Se reagoi tyydyttymättömien hiilivetyjen (alkeenien) kanssa haihdutetussa bensiinissä tuottaen aldehydejä ja ketoneja, jotka ärsyttävät silmiä. Kumi on polymeerimateriaali, joka sisältää 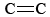 -sidoksia, joten sekin reagoi O3:n kanssa. Lisäksi alailmakehän otsoni ja siihen liittyvä savusumu on osoittautunut merkittäväksi terveysongelmaksi, sillä se ärsyttää ja vahingoittaa hengityselimiä ja on yhteydessä astmaan. Otsoni on siis hyödyllistä, kun se on yläilmakehässä, mutta sillä on haitallisia vaikutuksia, kun se on maanpinnan tasolla.
-sidoksia, joten sekin reagoi O3:n kanssa. Lisäksi alailmakehän otsoni ja siihen liittyvä savusumu on osoittautunut merkittäväksi terveysongelmaksi, sillä se ärsyttää ja vahingoittaa hengityselimiä ja on yhteydessä astmaan. Otsoni on siis hyödyllistä, kun se on yläilmakehässä, mutta sillä on haitallisia vaikutuksia, kun se on maanpinnan tasolla.
Rikkiä esiintyy useissa allotrooppisissa muodoissa. Huoneenlämmössä stabiilein muoto on rombinen rikki. Tämä keltainen kiinteä aine koostuu S8-molekyyleistä (jotka näkyvät alla olevassa Jmol-kuvassa), jotka on pakattu kideristikkoon, joka kuuluu orthorhombiseen järjestelmään (lueteltu sivulla, jossa käsitellään kidejärjestelmiä).
Kuva \(\PageIndex{1}\) S8-molekyyli: Alkuperäistä pallo- ja sauvamallia voidaan manipuloida kolmiulotteisessa avaruudessa. Klikkaa VdW-säteitä nähdäksesi saman molekyylin tilan täyttävän mallin.
Kun kiinteä rombinen rikki kuumennetaan 96 °C:seen, se muuttuu hyvin hitaasti monokliiniseksi rikiksi, jossa kolmasosa S8-molekyyleistä on satunnaisesti orientoitunut kideristikkoon. Kun molemmat rikkimuodot sulatetaan, neste on aluksi vaaleankeltaista ja virtaa helposti, mutta yli 160 °C:n lämpötilassa se muuttuu yhä viskoosimmaksi. Vasta lähellä kiehumispistettä 444,6 °C se ohenee jälleen. Tämä viskositeetin epätavallinen muutos lämpötilan mukaan johtuu S8:n kahdeksanjäsenisen renkaan avautumisesta ja pitkien rikkiatomiketjujen muodostumisesta. Nämä kietoutuvat toisiinsa ja estävät nestettä virtaamasta. Tätä selitystä tukee se, että jos viskoosinen neste jäähdytetään nopeasti kaatamalla se veteen, voidaan kokeellisesti osoittaa, että syntyvä amorfinen rikki koostuu pitkistä rikkiatomien ketjuista.
Sekä seleenillä että telluurilla on kiinteitä rakenteita, joissa atomit ovat sitoutuneet pitkiksi spiraaliketjuiksi. Molemmat ovat puolijohteita, ja seleenin sähkönjohtavuus riippuu alkuaineeseen osuvan valon voimakkuudesta. Tätä ominaisuutta hyödynnetään seleenivalokennoissa, joita käytetään usein valokuvauksen valotusmittareissa.
Seleniumia käytetään myös tasasuuntaajissa, jotka muuttavat vaihtosähkövirran tasavirraksi. Seleenin ja telluurin yhdisteillä on vähän kaupallista merkitystä, ja ne ovat usein myrkyllisiä. Lisäksi monilla niistä on paha haju, ne imeytyvät elimistöön ja erittyvät hikoilun ja hengityksen mukana. Nämä ominaisuudet ovat estäneet telluuri- ja seleeniyhdisteiden tutkimisen.
Kemialliset reaktiot ja yhdisteet
Happi Koska hapella on alkuaineista toiseksi suurin elektronegatiivisuus, se esiintyy useimmissa yhdisteissä hapetusasteessa -2 . Tärkeitä oksideja on jo käsitelty jaksoissa, joissa käsitellään alkuaineita, joista ne muodostuvat, joten tässä käsitellään vain hapen epätavallisia hapetusasteita. Yksi näistä on +2-tila, joka esiintyy OF2:ssa, joka on yleisin yhdiste, jossa happi on yhdistetty elektronegatiivisemman fluorin kanssa. Olemme jo maininneet alkalimetallien superoksideissa ja peroksideissa havaitut -½- ja -1-tilat, mutta yhtä tärkeää peroksidia, vetyperoksidia (H2O2), ei ole vielä käsitelty.
H2O2 voidaan valmistaa sulfaatti-ioneja sisältävien liuosten elektrolyysillä. H2O2 on heikko happo, ja se voi toimia hapettimena (happi pelkistyy -2-tilaan) tai pelkistävänä aineena (happi hapettuu 0-tilaan). Peroksidi-ionin tavoin H2O2-molekyyli sisältää O-O-yksilösidoksen. Tämä sidos on melko heikko verrattuna moniin muihin yksittäisiin sidoksiin, ja tämä vaikuttaa osaltaan H2O2:n reaktiivisuuteen. Yhdiste hajoaa helposti, erityisesti jos se altistuu valolle tai jos se on saastunut siirtymämetallien jäämien kanssa. Hajoaminen
\\voi tapahtua räjähdysmäisesti, jos kyseessä on puhdas neste.Rikki Vaikka tätä alkuaineita on maapallon pinnalla vain kuudestoistaosa, se on yksi niistä harvoista, jotka on tunnettu ja joita on käytetty kautta historian. Alkuaineena olevan rikin esiintymät eivät ole harvinaisia, ja koska ne olivat palavia kiviä, niitä kutsuttiin alun perin tulikiveksi. Rikin palaminen tuottaa rikkidioksidia,
\
Tämä väritön kaasu haisee tukahduttavalta ja on myrkyllisempi kuin hiilimonoksidi. Se on rikkihapon anhydridi, heikko diproottinen happo:
\
SO2 syntyy myös, kun lähes mitä tahansa rikkiä sisältävää ainetta poltetaan ilmassa. Esimerkiksi kivihiili sisältää yleensä 1-4 % rikkiä, joten kivihiilen poltosta vapautuu SO2 ilmakehään. Monet metallimalmit ovat sulfideja, ja kun niitä kuumennetaan ilmassa, syntyy SO2:ta. Esimerkiksi kuparia voidaan saada alkuaineena kuumentamalla kupari(I)sulfidia:
\
Koska SO2 on niin myrkyllistä, sen vapautuminen ilmakehään on suuri saastumisongelma. Ilmaan päästyään SO2 hapettuu hitaasti rikkitrioksidiksi, SO3:
\
Tämä yhdiste on rikkihapon, H2SO4:
\
rikkihapon anhydridi:
Jos ilmaa saastutetaan SO2:lla ja SO3:lla, ilmaan voi muodostua hienojakoinen sumu, joka koostuu laimeista pisaroista. Kaikki kolme ainetta ovat erittäin ärsyttäviä kurkulle ja keuhkoille, ja ne aiheuttavat huomattavia terveyshaittoja.
Rikkioksidien luonnollinen poistumismekanismi ilmasta on liukeneminen sadepisaroihin, jota seuraa saostuminen. Tämä tekee sadevedestä happamampaa kuin se muuten olisi, ja happamat sateet ovat nykyään yleisiä Yhdysvaltojen ja Euroopan teollistuneilla alueilla. Happamat sateet voivat hitaasti liuottaa kalkkikiveä ja marmoria, jotka molemmat koostuvat CaCO3:sta:
\
Siten näistä materiaaleista tehdyt patsaat ja rakennukset voivat vaurioitua.
Vaikka kivihiilen poltosta ja malmin sulatuksesta vapautuu ympäristöön valtava määrä rikkiä, tätä alkuaineita ei yleensä oteta talteen tällaisista prosesseista. Sen sijaan sitä saadaan kaupallisesti Yhdysvaltojen Persianlahden rannikon suurista esiintymistä ja hapanöljyn jalostuksesta. Hapan öljy sisältää lukuisia rikkiyhdisteitä, kuten H2S:ää, joka haisee mädille munille. Teksasin ja Louisianan alkuainerikkiesiintymät louhitaan Frasch-prosessilla. Rikki sulatetaan 170 °C:n lämpötilassa olevan veden avulla putkea pitkin, ja rikki pakotetaan paineilmalla pintaan. Suurin osa näistä lähteistä saatavasta H2S:stä tai S8:sta hapetetaan SO2:ksi, johdetaan vanadiinikatalysaattorin yli SO3:ksi ja liuotetaan veteen H2SO4:ksi. Vuonna 2005 maailmassa tuotettiin arviolta 190 miljardia kiloa H2SO4:ää, joten H2SO4 on yksi tärkeimmistä teollisuuskemikaaleista. Noin puolet siitä käytetään fosfaattilannoitteiden tuotannossa.
Puhdas H2SO4 on huoneenlämmössä nestemäistä ja sillä on suuri affiniteetti H2O:hon. Tämä johtuu ilmeisesti reaktiosta
\
H3O+:n muodostuminen vapauttaa energiaa, ja reaktio on eksoterminen. Tiivistetty H2SO4 on massaltaan 93 % H2SO4:ää ja 7 % H2O:ta, mikä vastaa yli kaksi kertaa enemmän H2SO4-molekyylejä kuin H2O-molekyylejä. Koska monilla H2SO4-molekyyleillä on vielä protoneja luovutettavana, väkevällä H2SO4:llä on myös suuri affiniteetti H2O:ta kohtaan. Sitä käytetään usein kuiva-aineena ja sitä voidaan käyttää kondensaatioreaktioissa, joissa syntyy H2O:ta.
- ”Montreal Protocol-One Page Factsheet.” ”Montreal Protocol-One Page Factsheet.” Ympäristönsuojeluvirasto. 6. syyskuuta 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. ”Statement on Health Effects of Air Pollution before the Senate Committee on Health, Education, Labor and Pensions, Subcommittee on Health”. Department of Health and Human Services. 3. syyskuuta 2003. www.hhs.gov/asl/testify/t020903.html
- Bala Suresh ja Yoshio Inoguchi. ”Rikkihappo”. SRI Consulting. July 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Tekijät
-
Ed Vitz (Kutztownin yliopisto), John W. Moore (University of Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Minnesota Rochesterin yliopisto), Tim Wendorff ja Adam Hahn.
.