A medida que nos acercamos al lado derecho de la tabla periódica, las similitudes entre los elementos de un grupo vuelven a ser mayores. Este es el caso del grupo VIA. Excepto el polonio, que es radiactivo y suele omitirse en la discusión, todos los miembros del grupo forman iones X2- cuando se combinan con metales altamente electropositivos. Sin embargo, la tendencia a reducirse al estado de oxidación -2 disminuye significativamente de arriba a abajo del grupo, y el telurio muestra algunas propiedades metálicas. Los elementos del grupo VIA se denominan calcógenos porque la mayoría de los minerales de cobre (chalkos griegos) son óxidos o sulfuros, y dichos minerales contienen trazas de selenio y telurio. Las propiedades atómicas de los calcógenos se resumen en la tabla.
| Elemento | Símbolo | Configuración de electrones | Estado de oxidación usual Estado | Radio/pm | |
|---|---|---|---|---|---|
| Covalente | Iónico (X2-) | ||||
| Oxígeno | O | 2s22p4 | -2 | 66 | 140 |
| Azufre | S | 3s23p4 | +6, +4, -2 | 104 | 184 |
| Selenio | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 |
| Telurio | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 |
| Símbolo | Energía de ionización/MJ mol-1 | Densidad/ g cm-3 | Electro- negatividad | Punto de fusión (en °C) | ||
|---|---|---|---|---|---|---|
| Primero | Segundo | Tercer | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2,257 | 3,367 | 2,06 | 2,5 | 119 |
| Se | 0,947 | 2.051 | 2,980 | 4,82 | 2,4 | 217 |
| Te | 0,876 | 1,800 | 2.704 | 6,25 | 2,1 | 450 |
A temperaturas y presiones ordinarias, el oxígeno es un gas. Existe en cualquiera de las dos formas alotrópicas: O2, que constituye el 21% de la atmósfera terrestre, u O3 (ozono), que se descompone lentamente en O2. El O3 puede prepararse haciendo pasar una descarga eléctrica a través del O2 o del aire:
\Nesta reacción se produce de forma natural como resultado de los rayos. El O3 también es producido por cualquier dispositivo que produzca chispas eléctricas. Es posible que haya notado su olor característico en las proximidades de un motor eléctrico, por ejemplo.
El ozono se forma en la estratosfera terrestre (entre las altitudes de 10 y. 50 km) por los rayos ultravioleta cuyas longitudes de onda son inferiores a 250 nm:
El propio ozono absorbe la radiación ultravioleta de mayor longitud de onda (hasta 340 nm), impidiendo que estos rayos dañinos lleguen a la superficie terrestre. De lo contrario, estos rayos aumentarían la incidencia del cáncer de piel en el ser humano y causarían otros problemas medioambientales. En los últimos años se han obtenido pruebas convincentes que demuestran que las emisiones de óxido de nitrógeno de los aviones de transporte supersónico (SST) (que vuelan en la estratosfera) pueden reducir la concentración de ozono. Se han obtenido conclusiones similares en relación con los clorofluorocarbonos (a veces denominados CFC) utilizados como propulsores en aerosoles para el cabello y desodorantes. Una vez en la atmósfera, una reacción fotoquímica hace que el cloro atómico se desprenda de los CFC. Este cloro atómico puede entonces participar en una reacción catalítica de agotamiento de la capa de ozono:
\️
\️
El cloro atómico se regenera, lo que significa que cada molécula de CFC tiene el potencial de agotar grandes cantidades de ozono. En la década de 1980, se determinó que el uso de productos químicos como los CFC estaba diluyendo el ozono estratosférico. También fue entonces cuando se descubrió el «agujero de ozono» sobre la Antártida. En respuesta al agotamiento del ozono, y al peligro que suponía, los líderes de múltiples países firmaron el Protocolo de Montreal relativo a las sustancias que agotan la capa de ozono, con el objetivo de eliminar progresivamente la producción y el uso de CFC y otras sustancias químicas perjudiciales para la capa de ozono. En la actualidad, 191 países han firmado el protocolo y, aunque se prevé que los niveles de ozono vuelvan a la normalidad hasta el año 2075, el Protocolo de Montreal ha demostrado ser un éxito.
El O3 también es un componente importante del smog fotoquímico. Se produce cuando los átomos de O (formados por la ruptura de los enlaces N-O del NO2) reaccionan con las moléculas según la Ec. \(\ref{3}\N). El O3 es un agente oxidante más fuerte que el O2. Reacciona con los hidrocarburos insaturados (alquenos) en la gasolina evaporada para producir aldehídos y cetonas que son irritantes para los ojos. El caucho es un material polimérico que contiene enlaces 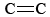 , por lo que también reacciona con el O3. Además, el ozono a nivel del suelo y la niebla tóxica que lo acompaña han demostrado ser un problema importante para la salud, ya que irritan y dañan el sistema respiratorio y también están relacionados con el asma. Así que el ozono es beneficioso cuando está en la atmósfera superior, pero tiene efectos adversos cuando está a nivel del suelo.
, por lo que también reacciona con el O3. Además, el ozono a nivel del suelo y la niebla tóxica que lo acompaña han demostrado ser un problema importante para la salud, ya que irritan y dañan el sistema respiratorio y también están relacionados con el asma. Así que el ozono es beneficioso cuando está en la atmósfera superior, pero tiene efectos adversos cuando está a nivel del suelo.
El azufre se presenta en una variedad de formas alotrópicas. A temperatura ambiente, la forma más estable es el azufre rómbico. Este sólido amarillo está formado por moléculas de S8 (que se ven en el Jmol de abajo) empaquetadas en una red cristalina que pertenece al sistema ortorrómbico (enumerado en la página que habla de los sistemas cristalinos).
Figura (\PageIndex{1}) molécula de S8: El modelo inicial de bola y palo puede ser manipulado en el espacio tridimensional. Haga clic en los radios VdW para ver un modelo de llenado de espacio de la misma molécula.
Cuando se calienta a 96°C, el azufre rómbico sólido se transforma muy lentamente en azufre monoclínico, en el que un tercio de las moléculas de S8 se orientan al azar en la red cristalina. Cuando se funde cualquiera de las dos formas de azufre, el líquido es al principio de color amarillo pálido y fluye con facilidad, pero por encima de 160°C se vuelve cada vez más viscoso. Sólo cerca del punto de ebullición de 444,6°C vuelve a diluirse. Este inusual cambio de viscosidad con la temperatura se atribuye a la apertura del anillo de ocho miembros de S8 y a la formación de largas cadenas de átomos de azufre. Éstas se entrelazan e impiden que el líquido fluya. Esta explicación se apoya en el hecho de que si el líquido viscoso se enfría rápidamente vertiéndolo en agua, se puede demostrar experimentalmente que el azufre amorfo producido está formado por largas cadenas de átomos de azufre.
Tanto el selenio como el telurio tienen estructuras sólidas en las que los átomos están unidos en largas cadenas en espiral. Ambos son semiconductores, y la conductividad eléctrica del selenio depende de la intensidad de la luz que incide sobre el elemento. Esta propiedad se aprovecha en las fotocélulas de selenio, que suelen utilizarse en los exposímetros fotográficos.
El selenio también se utiliza en los rectificadores para convertir la corriente eléctrica alterna en corriente continua. Los compuestos de selenio y telurio tienen poca importancia comercial y a menudo son tóxicos. Además, muchos de ellos tienen un olor desagradable, son absorbidos por el cuerpo y se desprenden con la transpiración y el aliento. Estas propiedades han inhibido el estudio de los compuestos de telurio y selenio.
Reacciones químicas y compuestos
Oxígeno Como el oxígeno tiene la segunda mayor electronegatividad entre todos los elementos, se encuentra en el estado de oxidación -2 en la mayoría de los compuestos. Los óxidos importantes ya han sido discutidos en las secciones que tratan de los elementos a partir de los cuales se forman, por lo que aquí sólo trataremos los estados de oxidación inusuales del oxígeno. Uno de ellos es el estado +2 que se encuentra en el OF2, el compuesto más común en el que el oxígeno se combina con el flúor, más electronegativo. Ya hemos mencionado los estados -½ y -1 observados en los superóxidos y peróxidos de metales alcalinos, pero un peróxido importante, el peróxido de hidrógeno (H2O2), aún no ha sido discutido.
El H2O2 puede ser preparado por electrólisis de soluciones que contienen iones sulfato. El H2O2 es un ácido débil, y puede servir como agente oxidante (el oxígeno se reduce al estado -2) o como agente reductor (el oxígeno se oxida al estado 0). Al igual que el ion peróxido, la molécula de H2O2 contiene un enlace simple O-O. Este enlace es bastante débil en comparación con muchos otros enlaces simples, y esto contribuye a la reactividad del H2O2. El compuesto se descompone fácilmente, especialmente si se expone a la luz o se contamina con trazas de metales de transición. La descomposición
puede producirse de forma explosiva en el caso del líquido puro.Azufre Aunque este elemento sólo es el decimosexto en abundancia en la superficie de la tierra, es uno de los pocos que se ha conocido y utilizado a lo largo de la historia. Los depósitos de azufre elemental no son infrecuentes y, por tratarse de piedras que arden, se llamaban originalmente azufre. La combustión del azufre produce dióxido de azufre,
Este gas incoloro tiene un olor asfixiante y es más venenoso que el monóxido de carbono. Es el anhídrido del ácido sulfuroso, un ácido diprótico débil:
El SO2 también se produce cuando se quema en el aire casi cualquier sustancia que contenga azufre. El carbón, por ejemplo, suele contener entre un 1 y un 4% de azufre, por lo que su combustión libera SO2 a la atmósfera. Muchos minerales metálicos son sulfuros, y cuando se calientan en el aire, se produce SO2. El cobre, por ejemplo, puede obtenerse como elemento calentando el sulfuro de cobre(I):
Como el SO2 es tan venenoso, su liberación a la atmósfera es un gran problema de contaminación. Una vez en el aire, el SO2 se oxida lentamente a trióxido de azufre, SO3:
Este compuesto es el anhídrido del ácido sulfúrico, H2SO4:
Por tanto, si el aire se contamina con SO2 y SO3, se puede formar una fina niebla de gotas diluidas. Las tres sustancias son muy irritantes para la garganta y los pulmones y son responsables de daños considerables para la salud humana.
El mecanismo natural de eliminación de los óxidos de azufre del aire es la disolución en las gotas de lluvia, seguida de la precipitación. Esto hace que el agua de lluvia sea más ácida de lo que sería de otro modo, y la lluvia ácida es ahora común en las zonas industrializadas de Estados Unidos y Europa. La lluvia ácida puede disolver lentamente la piedra caliza y el mármol, ambos formados por CaCO3:
\Nde ahí que las estatuas y los edificios hechos con estos materiales puedan resultar dañados.
A pesar de que se libera una enorme cantidad de azufre al medio ambiente por la combustión del carbón y la fundición de minerales, este elemento no suele recuperarse de estos procesos. En cambio, se obtiene comercialmente de grandes depósitos a lo largo de la Costa del Golfo de Estados Unidos y del refinado del petróleo agrio. El petróleo agrio contiene numerosos compuestos de azufre, incluido el H2S, que huele a huevos podridos. Los depósitos de azufre elemental de Texas y Luisiana se extraen mediante el proceso Frasch. Se bombea agua a 170°C por una tubería para fundir el azufre, y éste es forzado a salir a la superficie mediante aire comprimido. La mayor parte del H2S o S8 obtenido de estas fuentes se oxida a SO2, se pasa por un catalizador de vanadio para hacer SO3 y se disuelve en agua para hacer H2SO4. Se calcula que en 2005 se produjeron 190.000 millones de kg de H2SO4 en el mundo, lo que convierte al H2SO4 en uno de los productos químicos industriales más importantes. Aproximadamente la mitad se utiliza en la producción de fertilizantes fosfatados.
El H2SO4 puro es un líquido a temperatura ambiente y tiene una gran afinidad por el H2O. Esto se debe, aparentemente, a la reacción
\Nde la formación de H3O+ que libera energía, y la reacción es exotérmica. El H2SO4 concentrado tiene un 93% de H2SO4 y un 7% de H2O en masa, lo que corresponde a más del doble de moléculas de H2SO4 que de H2O. Como muchas moléculas de H2SO4 todavía tienen protones que donar, el H2SO4 concentrado también tiene una gran afinidad por el H2O. Se utiliza a menudo como agente desecante y puede emplearse en reacciones de condensación que desprenden H2O.
- «Montreal Protocol-One Page Factsheet». Agencia de Protección del Medio Ambiente. 6 de septiembre de 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. «Statement on Health Effects of Air Pollution before the Senate Committee on Health, Education, Labor and Pensions, Subcommittee on Health». Departamento de Salud y Servicios Humanos. 3 de septiembre de 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh y Yoshio Inoguchi. «Ácido sulfúrico». SRI Consulting. Julio de 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Contribuidores
-
Ed Vitz (Universidad de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Universidad de Minnesota Rochester), Tim Wendorff y Adam Hahn.