A mano a mano che ci avviciniamo al lato destro della tavola periodica, le somiglianze tra gli elementi di un gruppo diventano di nuovo maggiori. Questo è vero per il gruppo VIA. Tranne il polonio, che è radioattivo e solitamente omesso dalla discussione, tutti i membri del gruppo formano ioni X2- quando sono combinati con metalli altamente elettropositivi. La tendenza ad essere ridotto allo stato di ossidazione -2 diminuisce significativamente dall’alto verso il basso del gruppo, tuttavia, e il tellurio mostra alcune proprietà metalliche. Gli elementi del gruppo VIA sono chiamati calcogeni perché la maggior parte dei minerali di rame (chalkos greco) sono ossidi o solfuri, e tali minerali contengono tracce di selenio e tellurio. Le proprietà atomiche dei calcogeni sono riassunte nella tabella.
| Elemento | Simbolo | Configurazione dell’elettrone | Usua ossidazione Stato | Raggio/pm | |
|---|---|---|---|---|---|
| Covalente | Ionico (X2-) | ||||
| Ossigeno | O | 2s22p4 | -2 | 66 | 140 |
| Zolfo | S | 3s23p4 | +6, +4, -2 | 104 | 184 |
| Selenio | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 |
| Tellurio | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 |
| Simbolo | Energia di ionizzazione/MJ mol-1 | Densità/ g cm-3 | Elettro- negatività | Punto di fusione (in °C) | ||
|---|---|---|---|---|---|---|
| Prima | Secondo | Terzo | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2.257 | 3.367 | 2.06 | 2.5 | 119 |
| Se | 0.947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 |
| Te | 0.876 | 1.800 | 2.704 | 6.25 | 2.1 | 450 |
A temperature e pressioni ordinarie, l’ossigeno è un gas. Esiste in una delle due forme allotropiche: O2, che costituisce il 21% dell’atmosfera terrestre, o O3 (ozono), che si decompone lentamente in O2. L’O3 può essere preparato facendo passare una scarica elettrica attraverso l’O2 o l’aria:
Questa reazione avviene naturalmente come risultato dei fulmini. L’O3 è anche prodotto da qualsiasi dispositivo che produce scintille elettriche. Potresti aver notato il suo odore caratteristico in prossimità di un motore elettrico, per esempio.
L’ozono si forma nella stratosfera terrestre (tra le altitudini di 10 e 50 km) dai raggi ultravioletti le cui lunghezze d’onda sono inferiori a 250 nm:
L’ozono stesso assorbe le radiazioni ultraviolette di lunghezza d’onda maggiore (fino a 340 nm), impedendo a questi raggi nocivi di raggiungere la superficie terrestre. Altrimenti questi raggi aumenterebbero l’incidenza del cancro alla pelle umana e causerebbero altri problemi ambientali. Negli ultimi anni sono state ottenute prove convincenti per dimostrare che le emissioni di ossido di azoto dagli aerei da trasporto supersonico (SST) (che volano nella stratosfera) possono ridurre la concentrazione di ozono. Conclusioni simili sono state tratte riguardo ai clorofluorocarburi (a volte chiamati CFC) usati come propellenti negli aerosol per capelli e nei deodoranti. Una volta nell’atmosfera, una reazione fotochimica causa la rottura del cloro atomico dai CFC. Questo cloro atomico può poi partecipare ad una reazione catalitica di riduzione dell’ozono:
Il cloro atomico viene rigenerato, il che significa che ogni molecola di CFC ha il potenziale di ridurre grandi quantità di ozono. Negli anni ’80, è stato determinato che l’uso di sostanze chimiche come i CFC stava assottigliando l’ozono stratosferico. Questo è anche il momento in cui è stato scoperto il “buco dell’ozono” sopra l’Antartide. In risposta all’impoverimento dell’ozono e al pericolo che ne derivava, il Protocollo di Montreal sulle sostanze che impoveriscono lo strato di ozono fu firmato dai leader di diversi paesi, con l’obiettivo di eliminare gradualmente la produzione e l’uso di CFC e di altre sostanze chimiche dannose per lo strato di ozono. Oggi, 191 paesi hanno firmato il protocollo, e mentre si prevede che ci vorrà fino al 2075 perché i livelli di ozono tornino alla normalità, il protocollo di Montreal si è finora dimostrato un successo.
O3 è anche un componente importante dello smog fotochimico. Viene prodotto quando gli atomi di O (formati dalla rottura dei legami N-O in NO2) reagiscono con le molecole secondo l’Eq. \(\ref{3}). L’O3 è un agente ossidante più forte dell’O2. Reagisce con gli idrocarburi insaturi (alcheni) nella benzina evaporata per produrre aldeidi e chetoni che sono irritanti per gli occhi. La gomma è un materiale polimerico che contiene legami 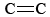 , e quindi anch’essa reagisce con O3. Inoltre, l’ozono a livello del suolo e lo smog che lo accompagna hanno dimostrato di essere una preoccupazione significativa per la salute, irritando e danneggiando il sistema respiratorio e avendo anche collegamenti con l’asma. Quindi l’ozono è benefico quando si trova nell’atmosfera superiore, ma ha effetti negativi quando si trova a livello del suolo.
, e quindi anch’essa reagisce con O3. Inoltre, l’ozono a livello del suolo e lo smog che lo accompagna hanno dimostrato di essere una preoccupazione significativa per la salute, irritando e danneggiando il sistema respiratorio e avendo anche collegamenti con l’asma. Quindi l’ozono è benefico quando si trova nell’atmosfera superiore, ma ha effetti negativi quando si trova a livello del suolo.
Lo zolfo si presenta in una varietà di forme allotropiche. A temperatura ambiente la forma più stabile è lo zolfo rombico. Questo solido giallo consiste di molecole S8 (viste nel Jmol qui sotto) impacchettate in un reticolo cristallino che appartiene al sistema ortorombico (elencato nella pagina che parla dei sistemi cristallini).
Figura \(\PageIndex{1}) molecola S8: Il modello iniziale di palla e bastone può essere manipolato nello spazio tridimensionale. Clicca sui raggi VdW per vedere un modello di riempimento dello spazio della stessa molecola.
Quando viene riscaldato a 96°C, lo zolfo rombico solido si trasforma molto lentamente in zolfo monoclino, in cui un terzo delle molecole S8 sono orientate in modo casuale nel reticolo cristallino. Quando entrambe le forme di zolfo si fondono, il liquido è inizialmente giallo pallido e scorre facilmente, ma sopra i 160°C diventa sempre più viscoso. Solo vicino al punto di ebollizione di 444,6°C si assottiglia di nuovo. Questo insolito cambiamento di viscosità con la temperatura è attribuito all’apertura dell’anello a otto membri di S8 e alla formazione di lunghe catene di atomi di zolfo. Queste si intrecciano e impediscono al liquido di scorrere. Questa spiegazione è supportata dal fatto che se il liquido viscoso è raffreddato rapidamente versandolo in acqua, lo zolfo amorfo prodotto può essere dimostrato sperimentalmente che consiste di lunghe catene di atomi di zolfo.
Sia il selenio che il tellurio hanno strutture solide in cui gli atomi sono legati in lunghe catene a spirale. Entrambi sono semiconduttori, e la conduttività elettrica del selenio dipende dall’intensità della luce che cade sull’elemento. Questa proprietà è utilizzata nelle fotocellule di selenio, che sono spesso usate negli esposimetri fotografici.
Il selenio è anche usato nei raddrizzatori per convertire la corrente elettrica alternata in corrente continua. I composti di selenio e tellurio sono di poca importanza commerciale, e spesso sono tossici. Inoltre, molti di loro hanno odori sgradevoli, sono assorbiti dal corpo, e sono emessi nel sudore e nel respiro. Queste proprietà hanno inibito lo studio dei composti di tellurio e selenio.
Reazioni e composti chimici
Ossigeno Poiché l’ossigeno ha la seconda maggiore elettronegatività tra tutti gli elementi, si trova nello stato di ossidazione -2 nella maggior parte dei composti. Gli ossidi importanti sono già stati discussi nelle sezioni che trattano gli elementi da cui si formano, e quindi qui ci occuperemo solo degli stati di ossidazione insoliti dell’ossigeno. Uno di questi è lo stato +2 che si trova in OF2, il composto più comune in cui l’ossigeno è combinato con il fluoro più elettronegativo. Abbiamo già menzionato gli stati -½ e -1 osservati nei superossidi e nei perossidi dei metalli alcalini, ma un importante perossido, il perossido di idrogeno (H2O2), non è stato ancora discusso.
H2O2 può essere preparato per elettrolisi di soluzioni contenenti ioni solfato. L’H2O2 è un acido debole e può servire come agente ossidante (l’ossigeno viene ridotto allo stato -2) o come agente riducente (l’ossigeno viene ossidato allo stato 0). Come lo ione perossido, la molecola H2O2 contiene un legame singolo O-O. Questo legame è piuttosto debole rispetto a molti altri legami singoli, e questo contribuisce alla reattività dell’H2O2. Il composto si decompone facilmente, specialmente se esposto alla luce o contaminato con tracce di metalli di transizione. La decomposizione può avvenire in modo esplosivo nel caso del liquido puro.Zolfo Anche se questo elemento è solo sedicesimo in abbondanza sulla superficie della terra, è uno dei pochi che è stato conosciuto e usato nel corso della storia. I depositi di zolfo elementare non sono rari e, poiché erano pietre che bruciavano, erano originariamente chiamati brimstone. La combustione dello zolfo produce anidride solforosa,
Questo gas incolore ha un odore soffocante ed è più velenoso del monossido di carbonio. È l’anidride dell’acido solforoso, un acido diprotico debole:
SO2 è prodotto anche quando quasi ogni sostanza contenente zolfo viene bruciata in aria. Il carbone, per esempio, di solito contiene dall’1 al 4% di zolfo, e quindi bruciare il carbone rilascia SO2 nell’atmosfera. Molti minerali metallici sono solfuri, e quando vengono riscaldati in aria, viene prodotta SO2. Il rame, per esempio, può essere ottenuto come elemento riscaldando il solfuro di rame(I):
\
Poiché l’SO2 è così velenoso, il suo rilascio nell’atmosfera è un grande problema di inquinamento. Una volta nell’aria, la SO2 si ossida lentamente in triossido di zolfo, SO3:
Questo composto è l’anidride dell’acido solforico, H2SO4:
Quindi se l’aria è inquinata con SO2 e SO3, si può formare una nebbia fine di goccioline diluite. Tutte e tre le sostanze sono molto irritanti per la gola e i polmoni e sono responsabili di notevoli danni alla salute umana.
Il meccanismo naturale di rimozione degli ossidi di zolfo dall’aria è la soluzione nelle gocce di pioggia, seguita dalla precipitazione. Questo rende l’acqua piovana più acida di quanto sarebbe altrimenti, e la pioggia acida è ora comune nelle aree industrializzate degli Stati Uniti e dell’Europa. Le piogge acide possono dissolvere lentamente il calcare e il marmo, entrambi costituiti da CaCO3:
Quindi le statue e gli edifici fatti di questi materiali possono essere danneggiati.
Nonostante il fatto che una quantità enorme di zolfo sia rilasciata nell’ambiente dalla combustione del carbone e dalla fusione dei minerali, questo elemento non è solitamente recuperato da tali processi. Invece è ottenuto commercialmente da grandi depositi lungo la costa del Golfo degli Stati Uniti e dalla raffinazione del petrolio acido. Il petrolio acido contiene numerosi composti dello zolfo, compreso H2S, che puzza come uova marce. I depositi di zolfo elementare in Texas e Louisiana sono estratti con il processo Frasch. L’acqua a 170°C viene pompata lungo un tubo per sciogliere lo zolfo, e quest’ultimo viene spinto in superficie da aria compressa. La maggior parte dell’H2S o S8 ottenuto da queste fonti è ossidato a SO2, passato su un catalizzatore di vanadio per fare SO3, e dissolto in acqua per fare H2SO4. Nel 2005 si stima che 190 miliardi di kg di H2SO4 siano stati prodotti nel mondo, rendendo l’H2SO4 uno dei più importanti prodotti chimici industriali. Circa la metà è usata nella produzione di fertilizzanti fosfatici.
L’H2SO4 puro è un liquido a temperatura ambiente e ha una grande affinità per l’H2O. Questo è apparentemente dovuto alla reazione
La formazione di H3O+ libera energia, e la reazione è esotermica. L’H2SO4 concentrato è il 93% di H2SO4 e il 7% di H2O in massa, che corrisponde a più del doppio di H2SO4 rispetto alle molecole di H2O. Poiché molte molecole di H2SO4 hanno ancora protoni da donare, l’H2SO4 concentrato ha anche una grande affinità per l’H2O. È spesso usato come agente essiccante e può essere impiegato in reazioni di condensazione che danno H2O.
- “Montreal Protocol-One Page Factsheet.” Agenzia per la protezione dell’ambiente. 6 settembre 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. “Dichiarazione sugli effetti sulla salute dell’inquinamento atmosferico prima del Comitato del Senato sulla salute, istruzione, lavoro e pensioni, sottocommissione sulla salute. Dipartimento della salute e dei servizi umani. 3 settembre 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh e Yoshio Inoguchi. “Acido solforico”. SRI Consulting. Luglio 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Contribuenti
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff e Adam Hahn.