Quando nos aproximamos do lado direito da tabela periódica, as semelhanças entre os elementos de um grupo tornam-se maiores novamente. Isto é verdade para o grupo VIA. Com exceção do polônio, que é radioativo e geralmente omitido da discussão, todos os membros do grupo formam íons X2- quando combinados com metais altamente eletropositivos. A tendência a ser reduzida ao estado de oxidação -2 diminui significativamente de cima para baixo do grupo, no entanto, e o telúrio mostra algumas propriedades metálicas. Os elementos do grupo VIA são chamados de calcogénicos porque a maioria dos minérios de cobre (calos gregos) são óxidos ou sulfetos, e tais minérios contêm vestígios de selénio e telúrio. As propriedades atómicas dos calcogéneos estão resumidas na tabela.
| Element | Símbolo | Configuração Electrónica | Oxidação Oral Estado | Radius/pm | ||
|---|---|---|---|---|---|---|
| Covalente | Iónico (X2-) | |||||
| Oxygen | O | 2s22p4 | -2 | 66 | 140 | |
| Sulfur | S | 3s23p4 | +6, +4, -2 | 104 | 184 | |
| Selenium | Se | 4s23d104p4 | >+6, +4, -2 | 117 | 198 | |
| Telúrio | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 | |
| Símbolo | Energia de ionização/MJ mol-1 | Densidade/ g cm-3 | Electro- negatividade | Ponto de fusão (em °C) | ||
|---|---|---|---|---|---|---|
| Primeiro | Segundo | Terceiro | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2,257 | 3,367 | 2,06 | 2,5 | 119 |
| Se | 0,947 | 2.051 | 2,980 | 4,82 | 2,4 | 217 |
| Te | 0,876 | 1,800 | 2.704 | 6,25 | 2,1 | 450 |
Em temperaturas e pressões normais, o oxigénio é um gás. Ele existe em qualquer uma das duas formas alotrópicas: O2, que compõe 21% da atmosfera terrestre, ou O3 (ozono), que se decompõe lentamente em O2. O3 pode ser preparado passando uma descarga elétrica através de O2 ou ar:
Esta reação ocorre naturalmente como resultado de relâmpagos. O3 também é produzido por qualquer dispositivo que produza faíscas elétricas. Pode ter notado o seu odor característico na proximidade de um motor eléctrico, por exemplo.
O ozono é formado na estratosfera terrestre (entre altitudes de 10 e 50 km) por raios ultravioletas cujos comprimentos de onda são inferiores a 250 nm:
\
\
O ozono em si absorve radiação ultravioleta de maior comprimento de onda (até 340 nm), impedindo que estes raios nocivos cheguem à superfície terrestre. Caso contrário, estes raios aumentariam a incidência de câncer de pele humana e causariam outros problemas ambientais. Nos últimos anos, foram obtidas provas convincentes de que as emissões de óxido de azoto dos aviões de transporte supersónico (SST) (que voam na estratosfera) podem reduzir a concentração de ozono. Foram tiradas conclusões semelhantes em relação aos clorofluorocarbonos (por vezes referidos como CFC) utilizados como propulsores em aerossóis e desodorizantes capilares. Uma vez na atmosfera, uma reacção fotoquímica provoca a quebra do cloro atómico dos CFC. Este cloro atómico pode então participar numa reacção de empobrecimento catalítico do ozono:
>
O cloro atómico é regenerado, o que significa que cada molécula de CFC tem o potencial de empobrecer grandes quantidades de ozono. Nos anos 80, determinou-se que o uso de produtos químicos como os CFC era o desbaste do ozono estratosférico. Isto também foi quando o “buraco de ozônio” sobre a Antártica foi descoberto. Em resposta ao esgotamento da camada de ozônio, e ao perigo apresentado por ela, foi assinado o Protocolo de Montreal sobre Substâncias que Esgotam a Camada de Ozônio por líderes de vários países, com o objetivo de eliminar gradualmente a produção e o uso de CFC e outras substâncias químicas nocivas à camada de ozônio. Hoje, 191 países assinaram o protocolo, e embora esteja previsto que leve até 2075 para que os níveis de ozônio voltem ao normal, o Protocolo de Montreal tem se mostrado um sucesso até agora.
O3 também é um componente importante do smog fotoquímico. É produzido quando os átomos de O (formados pela quebra das ligações N-O em NO2) reagem com moléculas de acordo com Eq. \Ref (3). O3 é um agente oxidante mais forte do que o O2. Ele reage com hidrocarbonetos insaturados (alcenos) na gasolina evaporada para produzir aldeídos e cetonas, que são irritantes para os olhos. A borracha é um material polimérico que contém 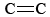 ligações, e por isso também reage com O3. Além disso, o ozono ao nível do solo e o smog que o acompanha provou ser uma preocupação de saúde significativa, irritando e danificando o sistema respiratório e tendo também ligações com a asma. Portanto, o ozono é benéfico quando se encontra na atmosfera superior, mas tem efeitos adversos quando se encontra ao nível do solo.
ligações, e por isso também reage com O3. Além disso, o ozono ao nível do solo e o smog que o acompanha provou ser uma preocupação de saúde significativa, irritando e danificando o sistema respiratório e tendo também ligações com a asma. Portanto, o ozono é benéfico quando se encontra na atmosfera superior, mas tem efeitos adversos quando se encontra ao nível do solo.
O enxofre ocorre numa variedade de formas alotrópicas. À temperatura ambiente, a forma mais estável é o enxofre rômbico. Este sólido amarelo consiste em moléculas S8 (vistas no Jmol abaixo) embaladas em uma malha de cristal que pertence ao sistema ortopédico (listado na página discutindo sistemas de cristal).
Figure {1}(PageIndex{1}}) Molécula S8: O modelo inicial de bola e bastão pode ser manipulado em espaço tridimensional. Clique nos raios VdW para ver um modelo de preenchimento de espaço da mesma molécula.
Quando aquecido a 96°C, o enxofre sólido rômbico muda muito lentamente para enxofre monoclínico, no qual um terço das moléculas S8 são orientadas aleatoriamente na malha de cristal. Quando qualquer uma das formas de enxofre derrete, o líquido é no início amarelo pálido e flui prontamente, mas acima de 160°C torna-se cada vez mais viscoso. Só perto do ponto de ebulição de 444,6°C ele afina para fora novamente. Esta mudança incomum em viscosidade com temperatura é atribuída à abertura do anel de oito membros de S8 e formação de cadeias longas de átomos de enxofre. Estes se entrelaçam e impedem que o líquido flua. Esta explicação é suportada pelo fato de que se o líquido viscoso é resfriado rapidamente vertendo-o em água, o enxofre amorfo produzido pode ser mostrado experimentalmente como consistindo de longas cadeias de átomos de enxofre.
Ambos selênio e telúrio possuem estruturas sólidas nas quais os átomos são ligados em longas cadeias espiraladas. Ambos são semicondutores, e a condutividade elétrica do selênio depende da intensidade da luz que cai sobre o elemento. Esta propriedade é utilizada em fotocélulas de selênio, que são frequentemente usadas em medidores de exposição fotográfica.
Selenium também é usado em retificadores para converter corrente elétrica alternada em corrente contínua. Compostos de selênio e telúrio são de pouca importância comercial, e muitas vezes são tóxicos. Além disso, muitos deles têm odores desagradáveis, são absorvidos pelo corpo e são expelidos na transpiração e na respiração. Estas propriedades têm inibido o estudo dos compostos telúrio e selénio.
Reacções Químicas e Compostos
Oxygen Uma vez que o oxigénio tem a segunda maior electronegatividade entre todos os elementos, é encontrado no estado de -2 oxidação na maioria dos compostos. Óxidos importantes já foram discutidos em seções que lidam com os elementos a partir dos quais eles se formam, e por isso aqui trataremos apenas dos estados de oxidação incomuns do oxigênio. Um deles é o estado +2 encontrado em OF2, o composto mais comum no qual o oxigênio é combinado com o flúor mais eletronegativo. Já mencionamos os estados -½ e -1 observados nos superóxidos e peróxidos de metais alcalinos, mas um peróxido importante, o peróxido de hidrogênio (H2O2), ainda não foi discutido.
H2O2 pode ser preparado por eletrólise de soluções contendo íons sulfato. H2O2 é um ácido fraco, e pode servir como um agente oxidante (o oxigênio sendo reduzido ao estado -2) ou como um agente redutor (o oxigênio sendo oxidado ao estado 0). Tal como o ião peróxido, a molécula de H2O2 contém uma única ligação O-O. Esta ligação é bastante fraca em comparação com muitas outras ligações únicas, e isto contribui para a reactividade do H2O2. O composto decompõe-se facilmente, especialmente se exposto à luz ou contaminado com vestígios de metais de transição. A decomposição
\ pode ocorrer explosivamente no caso do líquido puro. Enxofre Embora este elemento seja apenas um décimo sexto em abundância na superfície da terra, é um dos poucos que tem sido conhecido e utilizado ao longo da história. Os depósitos de enxofre elementar não são raros e, por serem pedras que queimariam, foram originalmente chamados de enxofre. O enxofre queimado produz dióxido de enxofre,
Este gás incolor tem um odor sufocante e é mais venenoso do que o monóxido de carbono. É o anidrido do ácido sulfuroso, um ácido diprótico fraco:
>
SO2 também é produzido quando quase qualquer substância contendo enxofre é queimada no ar. O carvão, por exemplo, geralmente contém de 1 a 4% de enxofre, e assim a queima do carvão liberta SO2 para a atmosfera. Muitos minérios metálicos são sulfuretos, e quando são aquecidos no ar, o SO2 é produzido. Cobre, por exemplo, pode ser obtido como o elemento aquecendo sulfato de cobre(I):
\\
SO2 é tão venenoso, sua liberação para a atmosfera é um grande problema de poluição. Uma vez no ar, o SO2 é lentamente oxidado em trióxido de enxofre, SO3:
>
>
Este composto é o anidrido do ácido sulfúrico, H2SO4:
>
Assim, se o ar é poluído com SO2 e SO3, uma fina névoa de gotas diluídas de lata se forma. Todas as três substâncias são muito irritantes para a garganta e pulmões e são responsáveis por danos consideráveis à saúde humana.
O mecanismo natural de remoção de óxidos de enxofre do ar é solução em gotas de chuva, seguido de precipitação. Isto torna a água da chuva mais ácida do que seria de outra forma, e a chuva ácida é agora comum em áreas industrializadas dos Estados Unidos e da Europa. A chuva ácida pode dissolver lentamente calcário e mármore, ambos compostos de CaCO3:
>
As estátuas e edifícios feitos destes materiais podem ser danificados.
Embora uma tremenda quantidade de enxofre seja liberada para o ambiente pela combustão do carvão e fundição de minério, este elemento não é normalmente recuperado de tais processos. Ao invés disso, ele é obtido comercialmente a partir de grandes depósitos ao longo da costa do Golfo dos EUA e do refino de petróleo azedo. O petróleo azedo contém numerosos compostos de enxofre, incluindo H2S, que cheira a ovos podres. Os depósitos de enxofre elementar no Texas e na Louisiana são extraídos pelo processo Frasch. A água a 170°C é bombeada por um tubo para derreter o enxofre, e o último é forçado à superfície por ar comprimido. A maioria do H2S ou S8 obtido destas fontes é oxidado a SO2, passado sobre um catalisador de vanádio para fazer SO3, e dissolvido em água para fazer H2SO4. Em 2005 foram produzidos cerca de 190 bilhões de kg de H2SO4 no mundo, tornando o H2SO4 um dos mais importantes produtos químicos industriais. Cerca de metade dele é utilizado na produção de fertilizantes fosfatados.
O H2SO4 puro é um líquido à temperatura ambiente e tem uma grande afinidade com o H2O. Isto é aparentemente devido à reação
Formação de H3O+ libera energia, e a reação é exotérmica. H2SO4 concentrado é 93% H2SO4 e 7% H2O por massa, correspondendo a mais do dobro de H2SO4 do que moléculas de H2O. Como muitas moléculas de H2SO4 ainda têm prótons para doar, o H2SO4 concentrado também tem uma grande afinidade com o H2O. Ele é frequentemente usado como um agente secante e pode ser empregado em reações de condensação que liberam H2O.
- “Protocolo de Montreal – Uma Folha de Dados”. Agência de Proteção Ambiental. 6 de Setembro de 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. “Declaração sobre os Efeitos da Poluição Atmosférica na Saúde perante a Comissão de Saúde, Educação, Trabalho e Pensões do Senado, Subcomissão de Saúde. Departamento de Saúde e Serviços Humanos. 3 de Setembro de 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh e Yoshio Inoguchi. “Ácido Sulfúrico”. Consultoria SRI. Julho de 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Contribuintes
-
Ed Vitz (Universidade de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Faculdade da Esperança), Xavier Prat-Resina (Universidade de Minnesota Rochester), Tim Wendorff, e Adam Hahn.