Naarmate we het rechterdeel van het periodiek systeem naderen, worden de overeenkomsten tussen de elementen binnen een groep weer groter. Dit is het geval met groep VIA. Behalve polonium, dat radioactief is en gewoonlijk buiten beschouwing wordt gelaten, vormen alle leden van de groep X2-ionen wanneer zij gecombineerd worden met hoog-elektropositieve metalen. De neiging om gereduceerd te worden tot de -2 oxidatietoestand neemt echter aanzienlijk af van boven naar beneden in de groep, en tellurium vertoont enige metallische eigenschappen. De groep VIA elementen worden chalcogenen genoemd omdat de meeste ertsen van koper (Grieks chalkos) oxiden of sulfiden zijn, en zulke ertsen bevatten sporen van selenium en tellurium. De atomaire eigenschappen van de chalcogenen zijn in de tabel samengevat.
| Element | Symbool | Elektronenconfiguratie | Uitgangsoxidatietoestand State | Radius/pm | |
|---|---|---|---|---|---|
| Covalent | Ionisch (X2-) | ||||
| Zuurstof | O | 2s22p4 | -2 | 66 | 140 |
| Zwavel | S | 3s23p4 | +6, +4, -2 | 104 | 184 |
| Selenium | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 |
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 |
| Symbool | Ionisatie-energie/MJ mol-1 | Dichtheid/ g cm-3 | Electro- negativiteit | Smeltpunt (in °C) | ||
|---|---|---|---|---|---|---|
| Eerste | Tweede | Derde | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2.257 | 3.367 | 2.06 | 2.5 | 119 |
| Se | 0.947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 |
| Te | 0.876 | 1.800 | 2.704 | 6.25 | 2.1 | 450 |
Bij gewone temperatuur en druk is zuurstof een gas. Het bestaat in een van de twee allotrope vormen: O2, dat 21 % van de atmosfeer van de aarde uitmaakt, of O3 (ozon), dat langzaam wordt afgebroken tot O2. O3 kan worden bereid door een elektrische ontlading door O2 of lucht te laten gaan:
Deze reactie vindt op natuurlijke wijze plaats als gevolg van bliksemschichten. O3 wordt ook geproduceerd door elk apparaat dat elektrische vonken produceert. Ozon wordt in de stratosfeer van de aarde (tussen 10 en 50 km hoogte) gevormd door ultraviolette stralen met een golflengte van minder dan 250 nm:
Ozon absorbeert ultraviolette straling met een langere golflengte (tot 340 nm), waardoor deze schadelijke straling het aardoppervlak niet kan bereiken. Anders zouden deze stralen het aantal gevallen van huidkanker bij de mens doen toenemen en andere milieuproblemen veroorzaken. De laatste jaren zijn overtuigende bewijzen verkregen dat de uitstoot van stikstofoxide door vliegtuigen voor supersonisch vervoer (SST) (die in de stratosfeer vliegen) de ozonconcentratie kan verminderen. Soortgelijke conclusies zijn getrokken met betrekking tot chloorfluorkoolwaterstoffen (soms CFK’s genoemd) die worden gebruikt als drijfgas in haarsprays en deodorants. Eenmaal in de atmosfeer zorgt een fotochemische reactie ervoor dat atomair chloor uit CFK’s wordt afgescheiden. Dit atomair chloor kan vervolgens deelnemen aan een katalytische ozonafbrekende reactie:
Het atomair chloor wordt geregenereerd, hetgeen betekent dat elke CFK-molecule het potentieel heeft om grote hoeveelheden ozon af te breken. In de jaren tachtig werd vastgesteld dat het gebruik van chemicaliën als CFK’s de stratosferische ozonlaag uitdunde. Toen werd ook het “gat in de ozonlaag” boven Antarctica ontdekt. Als reactie op de afbraak van de ozonlaag en het gevaar dat daardoor ontstond, werd het Protocol van Montreal betreffende stoffen die de ozonlaag afbreken ondertekend door leiders van verschillende landen, met als doel de productie en het gebruik van CFK’s en andere chemische stoffen die de ozonlaag aantasten, geleidelijk te beëindigen. Momenteel hebben 191 landen het protocol ondertekend, en hoewel het naar verwachting tot 2075 zal duren voordat de ozonconcentraties weer normaal zijn, is het Protocol van Montreal tot dusver een succes gebleken.
O3 is ook een belangrijk bestanddeel van fotochemische smog. Het ontstaat wanneer O-atomen (gevormd door het verbreken van N-O bindingen in NO2) reageren met moleculen volgens Eq. \. O3 is een sterker oxidatiemiddel dan O2. Het reageert met onverzadigde koolwaterstoffen (alkenen) in verdampte benzine tot aldehyden en ketonen die irriterend zijn voor de ogen. Rubber is een polymeer dat 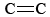 -bindingen bevat, en dus reageert het ook met O3. Verder is gebleken dat ozon op grondniveau en de daarmee gepaard gaande smog een belangrijk gezondheidsprobleem vormen, de ademhalingswegen irriteren en beschadigen en ook verband houden met astma. Ozon is dus heilzaam wanneer het zich in de bovenste atmosfeer bevindt, maar heeft nadelige gevolgen wanneer het zich op grondniveau bevindt.
-bindingen bevat, en dus reageert het ook met O3. Verder is gebleken dat ozon op grondniveau en de daarmee gepaard gaande smog een belangrijk gezondheidsprobleem vormen, de ademhalingswegen irriteren en beschadigen en ook verband houden met astma. Ozon is dus heilzaam wanneer het zich in de bovenste atmosfeer bevindt, maar heeft nadelige gevolgen wanneer het zich op grondniveau bevindt.
Zwavel komt voor in een verscheidenheid van allotrope vormen. Bij kamertemperatuur is de meest stabiele vorm rhombische zwavel. Deze gele vaste stof bestaat uit S8-moleculen (te zien in de Jmol hieronder) verpakt in een kristalrooster dat behoort tot het orthorhombische systeem (vermeld op de pagina over kristalsystemen).
Figuur S8-molecuul (Pagina-index{1}): Het oorspronkelijke bal- en stokmodel kan in de driedimensionale ruimte worden gemanipuleerd. Klik op VdW-stralen om een ruimtevullend model van hetzelfde molecuul te zien.
Bij verwarming tot 96°C verandert vast rhombisch zwavel zeer langzaam in monoklien zwavel, waarin een derde van de S8-moleculen willekeurig georiënteerd zijn in het kristalrooster. Wanneer beide vormen van zwavel smelten, is de vloeistof aanvankelijk lichtgeel en vloeit gemakkelijk, maar boven 160°C wordt zij steeds stroperiger. Pas bij het kookpunt van 444,6°C wordt de vloeistof weer dunner. Deze ongewone verandering van de viscositeit met de temperatuur wordt toegeschreven aan het openen van de achtledige ring van S8 en de vorming van lange ketens van zwavelatomen. Deze verstrengelen zich en verhinderen dat de vloeistof kan vloeien. Deze verklaring wordt ondersteund door het feit dat, als de viskeuze vloeistof snel wordt afgekoeld door deze in water te gieten, experimenteel kan worden aangetoond dat de amorfe zwavel die ontstaat bestaat uit lange ketens van zwavelatomen.
Zowel selenium als tellurium hebben vaste structuren waarin de atomen in lange spiraalvormige ketens aan elkaar zijn gebonden. Beide zijn halfgeleiders, en het elektrisch geleidingsvermogen van selenium hangt af van de intensiteit van het licht dat op het element valt. Deze eigenschap wordt gebruikt in selenium fotocellen, die vaak worden gebruikt in fotografische belichtingsmeters.
Selenium wordt ook gebruikt in gelijkrichters om wisselstroom om te zetten in gelijkstroom. Verbindingen van seleen en telluur zijn van weinig commercieel belang, en zijn vaak giftig. Bovendien hebben vele van hen een vieze geur, worden ze door het lichaam opgenomen en geven ze af via transpiratie en de adem. Deze eigenschappen hebben de studie van tellurium- en seleenverbindingen belemmerd.
Chemische reacties en verbindingen
Zuurstof Daar zuurstof de op één na grootste elektronegativiteit heeft van alle elementen, komt het in de meeste verbindingen voor in de -2 oxidatietoestand. Belangrijke oxiden zijn al besproken in de hoofdstukken over de elementen waaruit ze ontstaan, en daarom zullen we hier alleen de ongebruikelijke oxidatietoestanden van zuurstof behandelen. Eén daarvan is de +2 toestand in OF2, de meest voorkomende verbinding waarin zuurstof is gecombineerd met het meer elektronegatieve fluor. De -½ en -1 toestanden in superoxiden en peroxiden van alkalimetalen zijn reeds genoemd, maar een belangrijk peroxide, waterstofperoxide (H2O2), is nog niet besproken.
H2O2 kan worden bereid door elektrolyse van oplossingen die sulfaat-ionen bevatten. H2O2 is een zwak zuur, en het kan dienen als een oxidatiemiddel (zuurstof wordt gereduceerd tot de -2 toestand) of als een reductiemiddel (zuurstof wordt geoxideerd tot de 0 toestand). Evenals het peroxide-ion bevat het H2O2-molecuul een O-O enkelvoudige binding. Deze binding is vrij zwak in vergelijking met veel andere enkelvoudige bindingen, en dit draagt bij tot de reactiviteit van H2O2. De verbinding ontleedt gemakkelijk, vooral wanneer zij wordt blootgesteld aan licht of verontreinigd is met sporen van overgangsmetalen. De ontleding kan explosief verlopen in het geval van de zuivere vloeistof.Zwavel Hoewel dit element aan het aardoppervlak slechts zestiende in overvloed voorkomt, is het een van de weinige die in de loop van de geschiedenis bekend en gebruikt is geweest. Afzettingen van elementaire zwavel zijn niet ongewoon, en omdat het stenen waren die zouden branden, werden ze oorspronkelijk zwavelsteen genoemd. Bij verbranding van zwavel ontstaat zwaveldioxide,
Dit kleurloze gas heeft een verstikkende geur en is giftiger dan koolmonoxide. Het is het anhydride van zwavelig zuur, een zwak diprotisch zuur:
SO2 ontstaat ook wanneer bijna elke zwavelhoudende stof in lucht wordt verbrand. Steenkool bijvoorbeeld bevat gewoonlijk 1 tot 4% zwavel, zodat bij verbranding van steenkool SO2 in de atmosfeer vrijkomt. Veel metaalertsen zijn sulfiden, en wanneer zij in lucht worden verhit, ontstaat SO2. Koper, bijvoorbeeld, kan als element worden verkregen door koper(I)sulfide te verhitten:
Omdat SO2 zo giftig is, is het vrijkomen ervan in de atmosfeer een groot vervuilingsprobleem. Eenmaal in de lucht wordt SO2 langzaam geoxideerd tot zwaveltrioxide, SO3:
Deze verbinding is het anhydride van zwavelzuur, H2SO4:
Dus als de lucht met SO2 en SO3 wordt verontreinigd, kan zich een fijne nevel van verdunde druppeltjes vormen. Alle drie de stoffen zijn zeer irriterend voor keel en longen en zijn verantwoordelijk voor aanzienlijke schade aan de menselijke gezondheid.
Het natuurlijke mechanisme voor verwijdering van zwaveloxiden uit de lucht is oplossing in regendruppels, gevolgd door neerslag. Dit maakt het regenwater zuurder dan het anders zou zijn, en zure regen is nu gebruikelijk in geïndustrialiseerde gebieden van de Verenigde Staten en Europa. Zure regen kan kalksteen en marmer, die beide uit CaCO3 bestaan, langzaam doen oplossen:
Van dien aard kunnen standbeelden en gebouwen die van deze materialen zijn gemaakt, worden beschadigd.
Ondanks het feit dat bij de verbranding van steenkool en het smelten van ertsen een enorme hoeveelheid zwavel in het milieu vrijkomt, wordt dit element gewoonlijk niet uit dergelijke processen teruggewonnen. In plaats daarvan wordt het commercieel gewonnen uit grote afzettingen langs de Amerikaanse Golfkust en uit de raffinage van zure aardolie. Zure aardolie bevat talrijke zwavelverbindingen, waaronder H2S, dat ruikt naar rotte eieren. De afzettingen van elementaire zwavel in Texas en Louisiana worden gewonnen met het Frasch-proces. Water van 170°C wordt door een pijp gepompt om de zwavel te smelten, waarna deze met perslucht naar de oppervlakte wordt geperst. Het grootste deel van de H2S of S8 die uit deze bronnen wordt verkregen, wordt geoxideerd tot SO2, over een vanadiumkatalysator geleid om SO3 te maken, en in water opgelost om H2SO4 te maken. In 2005 werd in de wereld naar schatting 190 miljard kg H2SO4 geproduceerd, waarmee H2SO4 een van de belangrijkste industriële chemicaliën is. Ongeveer de helft ervan wordt gebruikt bij de productie van fosfaatmeststoffen.
Pure H2SO4 is een vloeistof bij kamertemperatuur en heeft een grote affiniteit voor H2O. Dit is blijkbaar het gevolg van de reactie
Bij de vorming van H3O+ komt energie vrij, en de reactie is exotherm. Geconcentreerd H2SO4 bestaat voor 93% uit H2SO4 en voor 7% uit H2O, wat overeenkomt met meer dan tweemaal zoveel H2SO4- als H2O-moleculen. Aangezien veel H2SO4-moleculen nog protonen kunnen afstaan, heeft geconcentreerd H2SO4 ook een grote affiniteit voor H2O. Het wordt vaak gebruikt als droogmiddel en kan worden gebruikt in condensatiereacties waarbij H2O vrijkomt.
- “Montreal Protocol-One Page Factsheet.” Environmental Protection Agency. 6 september 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. “Verklaring over de gezondheidseffecten van luchtverontreiniging voor de Senaatscommissie voor gezondheid, onderwijs, arbeid en pensioenen, subcommissie voor gezondheid. Department of Health and Human Services. 3 september 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh en Yoshio Inoguchi. “Sulfuric Acid”. SRI Consulting. Juli 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Bijdragers
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, and Adam Hahn.