Wenn man sich der rechten Seite des Periodensystems nähert, werden die Ähnlichkeiten zwischen den Elementen innerhalb einer Gruppe wieder größer. Dies trifft auf die Gruppe VIA zu. Mit Ausnahme von Polonium, das radioaktiv ist und normalerweise nicht besprochen wird, bilden alle Mitglieder der Gruppe X2-Ionen, wenn sie mit hoch elektropositiven Metallen kombiniert werden. Die Tendenz zur Reduktion auf die Oxidationsstufe -2 nimmt jedoch von oben nach unten in der Gruppe deutlich ab, und Tellur weist einige metallische Eigenschaften auf. Die Elemente der Gruppe VIA werden als Chalkogene bezeichnet, weil die meisten Kupfererze (griechisch chalkos) Oxide oder Sulfide sind und solche Erze Spuren von Selen und Tellur enthalten. Die atomaren Eigenschaften der Chalkogene sind in der Tabelle zusammengefasst.
| Element | Symbol | Elektronenkonfiguration | Eigener Oxidations Zustand | Radius/pm | |
|---|---|---|---|---|---|
| Kovalent | Ionisch (X2-) | ||||
| Sauerstoff | O | 2s22p4 | -2 | 66 | 140 |
| Schwefel | S | 3s23p4 | +6, +4, -2 | 104 | 184 |
| Selenium | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 |
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 |
| Symbol | Ionisierungsenergie/MJ mol-1 | Dichte/ g cm-3 | Elektro- Negativität | Schmelzpunkt (in °C) | ||
|---|---|---|---|---|---|---|
| Erste | Zweites | Drittes | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2.257 | 3.367 | 2.06 | 2.5 | 119 |
| Se | 0.947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 |
| Te | 0.876 | 1.800 | 2.704 | 6.25 | 2.1 | 450 |
Bei normalen Temperaturen und Drücken ist Sauerstoff ein Gas. Er kommt in zwei allotropen Formen vor: O2, das 21 Prozent der Erdatmosphäre ausmacht, oder O3 (Ozon), das sich langsam zu O2 zersetzt. O3 kann hergestellt werden, indem eine elektrische Entladung durch O2 oder Luft geleitet wird:
\
Diese Reaktion tritt auf natürliche Weise durch Blitze auf. O3 wird auch von jedem Gerät erzeugt, das elektrische Funken erzeugt. Vielleicht haben Sie den charakteristischen Geruch in der Nähe eines Elektromotors bemerkt.
Ozon wird in der Stratosphäre der Erde (zwischen 10 und 50 km Höhe) durch ultraviolette Strahlen gebildet, deren Wellenlänge kürzer als 250 nm ist:
\
\
Das Ozon selbst absorbiert längerwellige ultraviolette Strahlung (bis 340 nm) und verhindert so, dass diese schädlichen Strahlen die Erdoberfläche erreichen. Andernfalls würden diese Strahlen das Auftreten von Hautkrebs beim Menschen erhöhen und andere Umweltprobleme verursachen. In den letzten Jahren wurden überzeugende Beweise dafür erbracht, dass Stickoxidemissionen von Überschallflugzeugen (die in der Stratosphäre fliegen) die Ozonkonzentration verringern können. Ähnliche Schlussfolgerungen wurden in Bezug auf Fluorchlorkohlenwasserstoffe (manchmal auch als FCKW bezeichnet) gezogen, die als Treibmittel in Aerosol-Haarsprays und Deodorants verwendet werden. Sobald sie in die Atmosphäre gelangen, wird durch eine photochemische Reaktion atomares Chlor aus den FCKW abgespalten. Dieses atomare Chlor kann dann an einer katalytischen ozonabbauenden Reaktion teilnehmen:
\
\
Das atomare Chlor wird regeneriert, was bedeutet, dass jedes FCKW-Molekül das Potenzial hat, große Mengen an Ozon abzubauen. In den 1980er Jahren wurde festgestellt, dass die Verwendung von Chemikalien wie FCKW zu einer Ausdünnung des stratosphärischen Ozons führte. Zu dieser Zeit wurde auch das „Ozonloch“ über der Antarktis entdeckt. Als Reaktion auf den Abbau der Ozonschicht und die damit verbundene Gefahr wurde das Montrealer Protokoll über Stoffe, die zu einem Abbau der Ozonschicht führen, von führenden Politikern mehrerer Länder unterzeichnet, mit dem Ziel, die Produktion und Verwendung von FCKW und anderen ozonschädigenden Chemikalien einzustellen. Heute haben 191 Länder das Protokoll unterzeichnet, und obwohl es voraussichtlich bis 2075 dauern wird, bis sich die Ozonwerte wieder normalisiert haben, hat sich das Montrealer Protokoll bisher als Erfolg erwiesen.
O3 ist auch ein wichtiger Bestandteil des photochemischen Smogs. Es entsteht, wenn O-Atome (die durch das Aufbrechen von N-O-Bindungen in NO2 entstehen) mit Molekülen gemäß Gleichung reagieren. \(\ref{3}\). O3 ist ein stärkeres Oxidationsmittel als O2. Es reagiert mit ungesättigten Kohlenwasserstoffen (Alkenen) in verdampftem Benzin und erzeugt Aldehyde und Ketone, die augenreizend sind. Kautschuk ist ein polymeres Material, das 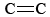 -Bindungen enthält, und reagiert daher ebenfalls mit O3. Darüber hinaus haben sich bodennahes Ozon und der damit einhergehende Smog als erhebliches Gesundheitsproblem erwiesen, da es die Atemwege reizt und schädigt und auch mit Asthma in Verbindung gebracht wird. Ozon ist also nützlich, wenn es sich in der oberen Atmosphäre befindet, hat aber negative Auswirkungen, wenn es sich in Bodennähe befindet.
-Bindungen enthält, und reagiert daher ebenfalls mit O3. Darüber hinaus haben sich bodennahes Ozon und der damit einhergehende Smog als erhebliches Gesundheitsproblem erwiesen, da es die Atemwege reizt und schädigt und auch mit Asthma in Verbindung gebracht wird. Ozon ist also nützlich, wenn es sich in der oberen Atmosphäre befindet, hat aber negative Auswirkungen, wenn es sich in Bodennähe befindet.
Schwefel kommt in einer Vielzahl von allotropen Formen vor. Bei Raumtemperatur ist die stabilste Form der rhombische Schwefel. Dieser gelbe Feststoff besteht aus S8-Molekülen (im Jmol unten zu sehen), die in ein Kristallgitter gepackt sind, das zum orthorhombischen System gehört (aufgeführt auf der Seite über Kristallsysteme).
Abbildung \(\PageIndex{1}\) S8-Molekül: Das ursprüngliche Kugel- und Stabmodell kann im dreidimensionalen Raum manipuliert werden. Klicken Sie auf VdW-Radien, um ein raumfüllendes Modell desselben Moleküls zu sehen.
Beim Erhitzen auf 96°C verwandelt sich fester rhombischer Schwefel sehr langsam in monoklinen Schwefel, bei dem ein Drittel der S8-Moleküle zufällig im Kristallgitter orientiert sind. Wenn beide Formen von Schwefel schmelzen, ist die Flüssigkeit zunächst blassgelb und fließt leicht, aber oberhalb von 160 °C wird sie zunehmend zähflüssig. Erst in der Nähe des Siedepunkts von 444,6 °C wird sie wieder dünnflüssig. Diese ungewöhnliche Änderung der Viskosität mit der Temperatur wird auf die Öffnung des achtgliedrigen Rings von S8 und die Bildung langer Ketten von Schwefelatomen zurückgeführt. Diese verschlingen sich und verhindern, dass die Flüssigkeit fließt. Diese Erklärung wird durch die Tatsache gestützt, dass, wenn die zähflüssige Flüssigkeit schnell abgekühlt wird, indem sie in Wasser gegossen wird, der entstehende amorphe Schwefel experimentell nachgewiesen werden kann, dass er aus langen Ketten von Schwefelatomen besteht.
Sowohl Selen als auch Tellur haben feste Strukturen, in denen die Atome in langen Spiralketten gebunden sind. Beide sind Halbleiter, und die elektrische Leitfähigkeit von Selen hängt von der Intensität des Lichts ab, das auf das Element fällt. Diese Eigenschaft wird in Selen-Fotozellen genutzt, die häufig in fotografischen Belichtungsmessern verwendet werden.
Selen wird auch in Gleichrichtern verwendet, um elektrischen Wechselstrom in Gleichstrom umzuwandeln. Verbindungen von Selen und Tellur sind von geringer kommerzieller Bedeutung und oft giftig. Außerdem haben viele von ihnen einen üblen Geruch, werden vom Körper aufgenommen und über Schweiß und Atemluft abgegeben. Diese Eigenschaften haben die Untersuchung von Tellur- und Selenverbindungen behindert.
Chemische Reaktionen und Verbindungen
Sauerstoff Da Sauerstoff die zweitgrößte Elektronegativität aller Elemente hat, liegt er in den meisten Verbindungen in der Oxidationsstufe -2 vor. Wichtige Oxide wurden bereits in den Abschnitten behandelt, die sich mit den Elementen befassen, aus denen sie entstehen, so dass wir uns hier nur mit ungewöhnlichen Oxidationsstufen von Sauerstoff befassen. Eine davon ist die Oxidationsstufe +2 in OF2, der häufigsten Verbindung, in der Sauerstoff mit dem elektronegativeren Fluor verbunden ist. Wir haben bereits die Zustände -½ und -1 erwähnt, die in Alkalimetallsuperoxiden und -peroxiden vorkommen, aber ein wichtiges Peroxid, das Wasserstoffperoxid (H2O2), wurde noch nicht behandelt.
H2O2 kann durch Elektrolyse von Lösungen hergestellt werden, die Sulfationen enthalten. H2O2 ist eine schwache Säure und kann als Oxidationsmittel (Sauerstoff wird zum Zustand -2 reduziert) oder als Reduktionsmittel (Sauerstoff wird zum Zustand 0 oxidiert) dienen. Wie das Peroxid-Ion enthält auch das H2O2-Molekül eine O-O-Einfachbindung. Diese Bindung ist im Vergleich zu vielen anderen Einfachbindungen eher schwach, was zur Reaktivität von H2O2 beiträgt. Die Verbindung zersetzt sich leicht, insbesondere wenn sie Licht ausgesetzt oder mit Spuren von Übergangsmetallen verunreinigt wird. Die Zersetzung kann im Falle der reinen Flüssigkeit explosionsartig erfolgen.Schwefel Obwohl dieses Element an der Erdoberfläche nur zu einem Sechzehntel vorkommt, ist es eines der wenigen, das im Laufe der Geschichte bekannt war und verwendet wurde. Ablagerungen von elementarem Schwefel sind keine Seltenheit und wurden ursprünglich Schwefel genannt, weil es sich um Steine handelte, die brennen würden. Bei der Verbrennung von Schwefel entsteht Schwefeldioxid,
\
Dieses farblose Gas hat einen erstickenden Geruch und ist giftiger als Kohlenmonoxid. Es ist das Anhydrid der schwefligen Säure, einer schwachen diprotischen Säure:
\
SO2 entsteht auch bei der Verbrennung fast aller schwefelhaltigen Stoffe an der Luft. Kohle zum Beispiel enthält in der Regel zwischen 1 und 4 % Schwefel, so dass bei der Verbrennung von Kohle SO2 in die Atmosphäre freigesetzt wird. Viele Metallerze sind Sulfide, und wenn sie an der Luft erhitzt werden, entsteht SO2. Kupfer zum Beispiel kann als Element durch Erhitzen von Kupfer(I)-sulfid gewonnen werden:
\
Da SO2 so giftig ist, stellt seine Freisetzung in die Atmosphäre ein großes Umweltproblem dar. In der Luft oxidiert SO2 langsam zu Schwefeltrioxid, SO3:
\
Diese Verbindung ist das Anhydrid der Schwefelsäure, H2SO4:
\
Wenn die Luft mit SO2 und SO3 verunreinigt ist, kann sich also ein feiner Nebel aus verdünnten Tröpfchen bilden. Alle drei Stoffe sind sehr reizend für Rachen und Lunge und verursachen erhebliche Gesundheitsschäden.
Der natürliche Mechanismus zur Entfernung von Schwefeloxiden aus der Luft ist die Lösung in Regentropfen, gefolgt von Niederschlägen. Dadurch wird das Regenwasser saurer als es sonst wäre, und saurer Regen ist heute in den industrialisierten Gebieten der Vereinigten Staaten und Europas üblich. Saurer Regen kann Kalkstein und Marmor, die beide aus CaCO3 bestehen, langsam auflösen:
\
Dadurch können Statuen und Gebäude aus diesen Materialien beschädigt werden.
Trotz der Tatsache, dass bei der Verbrennung von Kohle und der Verhüttung von Erzen enorme Mengen an Schwefel in die Umwelt gelangen, wird dieses Element bei solchen Prozessen normalerweise nicht zurückgewonnen. Stattdessen wird es kommerziell aus großen Lagerstätten entlang der US-Golfküste und aus der Raffination von saurem Erdöl gewonnen. Saures Erdöl enthält zahlreiche Schwefelverbindungen, darunter H2S, das nach faulen Eiern riecht. Die Lagerstätten von elementarem Schwefel in Texas und Louisiana werden nach dem Frasch-Verfahren abgebaut. Dabei wird 170 °C heißes Wasser in ein Rohr gepumpt, um den Schwefel zu schmelzen, der dann mit Hilfe von Druckluft an die Oberfläche gepresst wird. Der größte Teil des aus diesen Quellen gewonnenen H2S oder S8 wird zu SO2 oxidiert, über einen Vanadium-Katalysator geleitet, um SO3 zu erzeugen, und in Wasser aufgelöst, um H2SO4 herzustellen. Im Jahr 2005 wurden weltweit schätzungsweise 190 Milliarden kg H2SO4 hergestellt, was H2SO4 zu einer der wichtigsten Industriechemikalien macht. Etwa die Hälfte davon wird in der Phosphatdüngerproduktion verwendet.
Reines H2SO4 ist bei Raumtemperatur flüssig und hat eine große Affinität zu H2O. Dies ist offenbar auf die Reaktion
\
Bildung von H3O+ setzt Energie frei, und die Reaktion ist exotherm. Konzentrierte H2SO4 besteht zu 93 % aus H2SO4 und zu 7 % aus H2O, was mehr als doppelt so viele H2SO4- wie H2O-Moleküle bedeutet. Da viele H2SO4-Moleküle noch Protonen abgeben können, hat konzentriertes H2SO4 auch eine große Affinität zu H2O. Es wird häufig als Trocknungsmittel verwendet und kann in Kondensationsreaktionen eingesetzt werden, bei denen H2O entsteht.
- „Montreal Protocol-One Page Factsheet.“ Environmental Protection Agency. 6 September 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. „Statement on Health Effects of Air Pollution“ vor dem Senatsausschuss für Gesundheit, Bildung, Arbeit und Renten, Unterausschuss für Gesundheit. Department of Health and Human Services. 3. September 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh und Yoshio Inoguchi. „Sulfuric Acid“. SRI Consulting. July 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Beitragende
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, und Adam Hahn.