A mesure que l’on s’approche de la partie droite du tableau périodique, les similitudes entre les éléments d’un groupe redeviennent plus grandes. C’est le cas du groupe VIA. À l’exception du polonium, qui est radioactif et généralement omis de la discussion, tous les membres du groupe forment des ions X2- lorsqu’ils sont combinés avec des métaux hautement électropositifs. La tendance à être réduit à l’état d’oxydation -2 diminue toutefois de manière significative du haut en bas du groupe, et le tellure présente certaines propriétés métalliques. Les éléments du groupe VIA sont appelés chalcogènes car la plupart des minerais de cuivre (en grec chalkos) sont des oxydes ou des sulfures, et ces minerais contiennent des traces de sélénium et de tellure. Les propriétés atomiques des chalcogènes sont résumées dans le tableau.
| Élément | Symbole | Configuration des électrons | État d’oxydation usuel. Etat d’oxydation | Radius/pm | |
|---|---|---|---|---|---|
| Covalent | Ionique (X2-) | ||||
| Oxygène | O | 2s22p4 | -2 | 66 | 140 |
| Soufre | S | 3s23p4 | +6, +4, -2 | 104 | 184 |
| Sélénium | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 |
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 |
| Symbole | Energie d’ionisation/MJ mol-1 | Densité/ g cm-3 | Electro- négativité | Point de fusion (en °C) | ||
|---|---|---|---|---|---|---|
| Première | Seconde | Troisième | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2,257 | 3,367 | 2,06 | 2,5 | 119 |
| Se | 0,947 | 2.051 | 2,980 | 4,82 | 2,4 | 217 |
| Te | 0,876 | 1,800 | 2.704 | 6,25 | 2,1 | 450 |
À température et pression ordinaires, l’oxygène est un gaz. Il existe sous l’une des deux formes allotropiques : O2, qui constitue 21 % de l’atmosphère terrestre, ou O3 (ozone), qui se décompose lentement en O2. L’O3 peut être préparé en faisant passer une décharge électrique à travers l’O2 ou l’air:
\
Cette réaction se produit naturellement sous l’effet de la foudre. L’O3 est également produit par tout appareil qui produit des étincelles électriques. Vous avez peut-être remarqué son odeur distinctive à proximité d’un moteur électrique, par exemple.
L’ozone se forme dans la stratosphère terrestre (entre les altitudes de 10 et. 50 km) par les rayons ultraviolets dont la longueur d’onde est inférieure à 250 nm:
L’ozone lui-même absorbe les rayons ultraviolets de plus grande longueur d’onde (jusqu’à 340 nm), empêchant ces rayons nocifs d’atteindre la surface de la terre. Sinon, ces rayons augmenteraient l’incidence du cancer de la peau chez l’homme et causeraient d’autres problèmes environnementaux. Ces dernières années, des preuves convaincantes ont été obtenues pour montrer que les émissions d’oxyde d’azote des avions de transport supersonique (SST) (qui volent dans la stratosphère) peuvent réduire la concentration d’ozone. Des conclusions similaires ont été tirées concernant les chlorofluorocarbones (parfois appelés CFC) utilisés comme agents propulseurs dans les aérosols pour cheveux et les déodorants. Une fois dans l’atmosphère, une réaction photochimique fait que le chlore atomique se détache des CFC. Ce chlore atomique peut alors participer à une réaction catalytique d’appauvrissement de l’ozone :
\
\
Le chlore atomique est régénéré, ce qui signifie que chaque molécule de CFC a le potentiel d’appauvrir de grandes quantités d’ozone. Dans les années 1980, il a été déterminé que l’utilisation de produits chimiques tels que les CFC amincissait l’ozone stratosphérique. C’est également à cette époque que l’on a découvert le « trou d’ozone » au-dessus de l’Antarctique. En réponse à l’appauvrissement de la couche d’ozone et au danger qu’il représente, le protocole de Montréal relatif à des substances qui appauvrissent la couche d’ozone a été signé par les dirigeants de plusieurs pays, dans le but d’éliminer progressivement la production et l’utilisation des CFC et d’autres produits chimiques nocifs pour la couche d’ozone. Aujourd’hui, 191 pays ont signé le protocole et, bien qu’il faille attendre jusqu’en 2075 pour que les niveaux d’ozone reviennent à la normale, le protocole de Montréal s’est jusqu’à présent avéré un succès.
L’O3 est également un composant important du smog photochimique. Il est produit lorsque les atomes d’O (formés par la rupture des liaisons N-O dans le NO2) réagissent avec les molécules selon la formule Eq. \(\ref{3}\). L’O3 est un agent oxydant plus puissant que l’O2. Il réagit avec les hydrocarbures insaturés (alcènes) dans l’essence évaporée pour produire des aldéhydes et des cétones qui sont des irritants pour les yeux. Le caoutchouc est un matériau polymère qui contient des liaisons 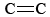 , il réagit donc lui aussi avec l’O3. En outre, l’ozone troposphérique et le smog qui l’accompagne se sont révélés être un problème de santé important, irritant et endommageant le système respiratoire et ayant également des liens avec l’asthme. L’ozone est donc bénéfique lorsqu’il se trouve dans la haute atmosphère, mais a des effets néfastes lorsqu’il se trouve au niveau du sol.
, il réagit donc lui aussi avec l’O3. En outre, l’ozone troposphérique et le smog qui l’accompagne se sont révélés être un problème de santé important, irritant et endommageant le système respiratoire et ayant également des liens avec l’asthme. L’ozone est donc bénéfique lorsqu’il se trouve dans la haute atmosphère, mais a des effets néfastes lorsqu’il se trouve au niveau du sol.
Le soufre se présente sous une variété de formes allotropiques. A température ambiante, la forme la plus stable est le soufre rhombique. Ce solide jaune est constitué de molécules S8 (vues dans le Jmol ci-dessous) emballées dans un réseau cristallin qui appartient au système orthorhombique (listé sur la page traitant des systèmes cristallins).
Figure \(\PageIndex{1}\) Molécule S8 : Le modèle initial de la boule et du bâton peut être manipulé dans un espace tridimensionnel. Cliquez sur les rayons VdW pour voir un modèle de remplissage d’espace de la même molécule.
Lorsqu’il est chauffé à 96°C, le soufre rhombique solide se transforme très lentement en soufre monoclinique, dans lequel un tiers des molécules S8 sont orientées de façon aléatoire dans le réseau cristallin. Lorsque l’une ou l’autre forme de soufre fond, le liquide est d’abord jaune pâle et s’écoule facilement, mais au-delà de 160°C, il devient de plus en plus visqueux. Ce n’est qu’à proximité du point d’ébullition de 444,6°C qu’il se fluidifie à nouveau. Ce changement inhabituel de la viscosité avec la température est attribué à l’ouverture du cycle à huit chaînons de S8 et à la formation de longues chaînes d’atomes de soufre. Celles-ci s’entrelacent et empêchent le liquide de s’écouler. Cette explication est soutenue par le fait que si le liquide visqueux est refroidi rapidement en le versant dans l’eau, on peut montrer expérimentalement que le soufre amorphe produit est constitué de longues chaînes d’atomes de soufre.
Le sélénium et le tellure ont tous deux des structures solides dans lesquelles les atomes sont liés en longues chaînes spiralées. Tous deux sont des semi-conducteurs, et la conductivité électrique du sélénium dépend de l’intensité de la lumière qui tombe sur l’élément. Cette propriété est utilisée dans les cellules photoélectriques au sélénium, qui sont souvent utilisées dans les posemètres photographiques.
Le sélénium est également utilisé dans les redresseurs pour convertir le courant électrique alternatif en courant continu. Les composés du sélénium et du tellure ont peu d’importance commerciale, et ils sont souvent toxiques. De plus, beaucoup d’entre eux ont une odeur désagréable, sont absorbés par l’organisme et se dégagent dans la transpiration et l’haleine. Ces propriétés ont empêché l’étude des composés du tellure et du sélénium.
Réactions et composés chimiques
Oxygène Comme l’oxygène possède la deuxième plus grande électronégativité parmi tous les éléments, on le trouve dans l’état d’oxydation -2 dans la plupart des composés. Les oxydes importants ont déjà été abordés dans les sections traitant des éléments à partir desquels ils se forment, et nous ne traiterons donc ici que des états d’oxydation inhabituels de l’oxygène. L’un d’eux est l’état +2 que l’on trouve dans OF2, le composé le plus courant dans lequel l’oxygène est combiné avec le fluor, plus électronégatif. Nous avons déjà mentionné les états -½ et -1 observés dans les superoxydes et les peroxydes des métaux alcalins, mais un peroxyde important, le peroxyde d’hydrogène (H2O2), n’a pas encore été abordé.
Le H2O2 peut être préparé par électrolyse de solutions contenant des ions sulfate. H2O2 est un acide faible, et il peut servir d’agent oxydant (l’oxygène étant réduit à l’état -2) ou d’agent réducteur (l’oxygène étant oxydé à l’état 0). Comme l’ion peroxyde, la molécule de H2O2 contient une liaison simple O-O. Cette liaison est plutôt faible par rapport à de nombreuses autres liaisons. Cette liaison est plutôt faible par rapport à de nombreuses autres liaisons simples, ce qui contribue à la réactivité du H2O2. Le composé se décompose facilement, surtout s’il est exposé à la lumière ou contaminé par des traces de métaux de transition. La décomposition
peut se produire de manière explosive dans le cas du liquide pur.Soufre Bien que cet élément ne soit que seize fois plus abondant à la surface de la terre, il est l’un des rares à avoir été connu et utilisé au cours de l’histoire. Les dépôts de soufre élémentaire ne sont pas rares et, comme il s’agissait de pierres qui brûlaient, on les appelait à l’origine le soufre. La combustion du soufre produit du dioxyde de soufre,
\
Ce gaz incolore a une odeur suffocante et est plus toxique que le monoxyde de carbone. C’est l’anhydride de l’acide sulfureux, un acide diprotique faible:
Le SO2 est également produit lorsque presque toute substance contenant du soufre est brûlée à l’air. Le charbon, par exemple, contient généralement de 1 à 4 % de soufre, et sa combustion libère donc du SO2 dans l’atmosphère. De nombreux minerais métalliques sont des sulfures, et lorsqu’ils sont chauffés à l’air, du SO2 est produit. Le cuivre, par exemple, peut être obtenu comme élément en chauffant du sulfure de cuivre(I):
\
Puisque le SO2 est si toxique, son rejet dans l’atmosphère est un problème de pollution majeur. Une fois dans l’air, le SO2 est lentement oxydé en trioxyde de soufre, SO3:
\
Ce composé est l’anhydride de l’acide sulfurique, H2SO4:
\
Ainsi, si l’air est pollué par du SO2 et du SO3, un fin brouillard de gouttelettes diluées de peut se former. Ces trois substances sont très irritantes pour la gorge et les poumons et sont responsables de dommages considérables pour la santé humaine.
Le mécanisme naturel d’élimination des oxydes de soufre de l’air est la solution dans les gouttes de pluie, suivie de précipitations. Cela rend l’eau de pluie plus acide qu’elle ne le serait autrement, et les pluies acides sont maintenant courantes dans les zones industrialisées des États-Unis et de l’Europe. Les pluies acides peuvent dissoudre lentement le calcaire et le marbre, tous deux constitués de CaCO3:
Par conséquent, les statues et les bâtiments construits dans ces matériaux peuvent être endommagés.
Malgré le fait qu’une énorme quantité de soufre est libérée dans l’environnement par la combustion du charbon et la fusion du minerai, cet élément n’est généralement pas récupéré à partir de ces processus. Au lieu de cela, il est obtenu commercialement à partir de grands gisements le long de la côte américaine du Golfe du Mexique et du raffinage du pétrole acide. Le pétrole acide contient de nombreux composés sulfurés, dont le H2S, qui a une odeur d’œuf pourri. Les gisements de soufre élémentaire au Texas et en Louisiane sont exploités par le procédé Frasch. De l’eau à 170°C est pompée dans un tuyau pour faire fondre le soufre, et ce dernier est poussé vers la surface par de l’air comprimé. La majeure partie du H2S ou S8 obtenu à partir de ces sources est oxydée en SO2, passe sur un catalyseur au vanadium pour produire du SO3 et est dissoute dans l’eau pour produire du H2SO4. En 2005, on estime que 190 milliards de kg de H2SO4 ont été produits dans le monde, ce qui fait du H2SO4 l’un des produits chimiques industriels les plus importants. Environ la moitié est utilisée dans la production d’engrais phosphatés.
Le H2SO4 pur est un liquide à température ambiante et a une grande affinité pour H2O. Ceci est apparemment dû à la réaction
\
La formation de H3O+ libère de l’énergie, et la réaction est exothermique. Le H2SO4 concentré est composé de 93% de H2SO4 et de 7% de H2O en masse, ce qui correspond à plus de deux fois plus de molécules de H2SO4 que de H2O. Comme de nombreuses molécules de H2SO4 ont encore des protons à donner, le H2SO4 concentré a également une grande affinité pour H2O. Il est souvent utilisé comme agent de séchage et peut être employé dans des réactions de condensation qui donnent du H2O.
- « Montreal Protocol-One Page Factsheet. » Agence de protection de l’environnement. 6 septembre 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. » Déclaration sur les effets de la pollution atmosphérique sur la santé devant le Comité sénatorial de la santé, de l’éducation, du travail et des pensions, sous-comité de la santé « . Département de la santé et des services sociaux. 3 septembre 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh et Yoshio Inoguchi. « Acide sulfurique ». SRI Consulting. Juillet 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Contributeurs
-
Ed Vitz (Université de Kutztown), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (Université du Minnesota Rochester), Tim Wendorff, et Adam Hahn.
.