Pe măsură ce ne apropiem de partea dreaptă a tabelului periodic, asemănările dintre elementele dintr-o grupă devin din nou mai mari. Acest lucru este valabil și în cazul grupei VIA. Cu excepția poloniului, care este radioactiv și de obicei omis din discuție, toți membrii grupului formează ioni X2- atunci când sunt combinați cu metale puternic electropozitive. Cu toate acestea, tendința de a fi redus la starea de oxidare -2 scade semnificativ de la vârful la baza grupului, iar telurul prezintă unele proprietăți metalice. Elementele din grupa VIA sunt numite calcogeni deoarece majoritatea minereurilor de cupru (greacă chalkos) sunt oxizi sau sulfuri, iar aceste minereuri conțin urme de seleniu și telur. Proprietățile atomice ale calcogenilor sunt rezumate în tabel.
| Element | Simbol | Configurație electronică | Oxidare uzuală Stare de oxidare | Radiu/pm | |||
|---|---|---|---|---|---|---|---|
| Covalent | Ionic (X2-) | ||||||
| Oxigen | O | 2s22p4 | -2 | 66 | 140 | ||
| Sulfur | S | 3s23p4 | +6, +4, -2 | 104 | 184 | ||
| Seleniu | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 | ||
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 | ||
| Simbol | Energie de ionizare/MJ mol-1 | Densitate/ g cm-3 | Densitate/ g cm-3 | Electro- negativitate | Punctul de topire (în °C) | |||
|---|---|---|---|---|---|---|---|---|
| Primul | Secundul | Al treilea | ||||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 | ||
| S | 1.006 | 2,257 | 3,367 | 2,06 | 2,5 | 119 | ||
| Se | 0,947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 | ||
| Te | 0.876 | 1.800 | 2.704 | 6,25 | 2,1 | 450 | ||
La temperaturi și presiuni obișnuite, oxigenul este un gaz. Acesta există în oricare dintre cele două forme alotropice: O2, care constituie 21 la sută din atmosfera terestră, sau O3 (ozon), care se descompune lent în O2. O3 poate fi preparat prin trecerea unei descărcări electrice prin O2 sau prin aer:
\
Această reacție are loc în mod natural ca urmare a fulgerelor. O3 este, de asemenea, produs de orice dispozitiv care produce scântei electrice. Este posibil să fi observat mirosul său distinctiv în apropierea unui motor electric, de exemplu.
Ozonul se formează în stratosfera terestră (între altitudinile de 10 și. 50 km) de către razele ultraviolete ale căror lungimi de undă sunt mai mici de 250 nm:
\
\
Ozonul însuși absoarbe radiațiile ultraviolete cu lungimi de undă mai mari (până la 340 nm), împiedicând aceste raze dăunătoare să ajungă la suprafața pământului. În caz contrar, aceste raze ar crește incidența cancerului de piele la om și ar cauza alte probleme de mediu. În ultimii ani, au fost obținute dovezi convingătoare care arată că emisiile de oxid de azot provenite de la avioanele de transport supersonic (SST) (care zboară în stratosferă) pot reduce concentrația de ozon. Concluzii similare au fost trase și în ceea ce privește clorofluorocarburile (denumite uneori CFC) utilizate ca propulsoare în aerosoli pentru spray-uri de păr și deodorante. Odată ajunși în atmosferă, o reacție fotochimică determină desprinderea clorului atomic din CFC-uri. Acest clor atomic poate participa apoi la o reacție catalitică de epuizare a ozonului:
\
\
Clorul atomic este regenerat, ceea ce înseamnă că fiecare moleculă de CFC are potențialul de a epuiza cantități mari de ozon. În anii 1980, s-a stabilit că utilizarea unor substanțe chimice precum CFC-urile subțiază stratul de ozon stratosferic. Tot atunci a fost descoperită și „gaura de ozon” de deasupra Antarcticii. Ca răspuns la epuizarea stratului de ozon și la pericolul reprezentat de aceasta, Protocolul de la Montreal privind substanțele care epuizează stratul de ozon a fost semnat de liderii mai multor țări, cu scopul de a elimina treptat producția și utilizarea CFC și a altor substanțe chimice dăunătoare stratului de ozon. În prezent, 191 de țări au semnat protocolul și, deși se estimează că va dura până în 2075 pentru ca nivelurile de ozon să revină la normal, Protocolul de la Montreal s-a dovedit până acum un succes.
O3 este, de asemenea, o componentă importantă a smogului fotochimic. Acesta este produs atunci când atomii de O (formați prin ruperea legăturilor N-O din NO2) reacționează cu moleculele conform Ec. \(\ref{3}\). O3 este un agent oxidant mai puternic decât O2. Acesta reacționează cu hidrocarburile nesaturate (alchene) din benzina evaporată pentru a produce aldehide și cetone care sunt iritante pentru ochi. Cauciucul este un material polimeric care conține legături 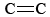 și, prin urmare, reacționează și el cu O3. Mai mult, ozonul de la nivelul solului și smogul care îl însoțește s-au dovedit a fi o preocupare semnificativă pentru sănătate, iritând și deteriorând sistemul respirator și având, de asemenea, legături cu astmul. Așadar, ozonul este benefic atunci când se află în atmosfera superioară, dar are efecte adverse atunci când se află la nivelul solului.
și, prin urmare, reacționează și el cu O3. Mai mult, ozonul de la nivelul solului și smogul care îl însoțește s-au dovedit a fi o preocupare semnificativă pentru sănătate, iritând și deteriorând sistemul respirator și având, de asemenea, legături cu astmul. Așadar, ozonul este benefic atunci când se află în atmosfera superioară, dar are efecte adverse atunci când se află la nivelul solului.
Sulfura se găsește într-o varietate de forme alotropice. La temperatura camerei, cea mai stabilă formă este sulful rombic. Acest solid galben este format din molecule S8 (observate în Jmol de mai jos) împachetate într-o rețea cristalină care aparține sistemului ortorombic (enumerat pe pagina care discută sistemele cristaline).
Figura \(\PageIndex{1}\) Molecula S8: Modelul inițial cu bilă și băț poate fi manipulat în spațiul tridimensional. Faceți clic pe razele VdW pentru a vedea un model de umplere a spațiului pentru aceeași moleculă.
Când este încălzit la 96°C, sulful rombic solid se transformă foarte lent în sulf monoclinic, în care o treime din moleculele S8 sunt orientate aleatoriu în rețeaua cristalină. Când oricare dintre formele de sulf se topește, lichidul este la început galben pal și curge ușor, dar peste 160°C devine din ce în ce mai vâscos. Doar în apropierea punctului de fierbere de 444,6°C se diluează din nou. Această schimbare neobișnuită a vâscozității în funcție de temperatură este atribuită deschiderii inelului cu opt membri al S8 și formării de lanțuri lungi de atomi de sulf. Aceștia se întrepătrund și împiedică lichidul să curgă. Această explicație este susținută de faptul că, dacă lichidul vâscos este răcit rapid prin turnarea lui în apă, se poate demonstra experimental că sulful amorf produs este format din lanțuri lungi de atomi de sulf.
Atât seleniul cât și telurul au structuri solide în care atomii sunt legați în lanțuri spiralate lungi. Ambele sunt semiconductori, iar conductivitatea electrică a seleniului depinde de intensitatea luminii care cade pe element. Această proprietate este utilizată în celulele fotoelectrice din seleniu, care sunt adesea folosite în exponometrele fotografice.
Seleniul este, de asemenea, utilizat în redresoare pentru a converti curentul electric alternativ în curent continuu. Compușii seleniului și telurului au o importanță comercială redusă și sunt adesea toxici. În plus, mulți dintre ei au mirosuri urât mirositoare, sunt absorbiți de organism și sunt degajați în transpirație și în respirație. Aceste proprietăți au inhibat studiul compușilor de telur și seleniu.
Reacții și compuși chimici
Oxigen Deoarece oxigenul are a doua cea mai mare electronegativitate dintre toate elementele, el se găsește în starea de oxidare -2 în majoritatea compușilor. Oxizii importanți au fost deja discutați în secțiunile care se ocupă de elementele din care se formează, așa că ne vom ocupa aici doar de stările de oxidare neobișnuite ale oxigenului. Una dintre acestea este starea +2 care se găsește în OF2, cel mai comun compus în care oxigenul este combinat cu fluorul mai electronegativ. Am menționat deja stările -½ și -1 observate în superoxizii și peroxizii metalelor alcaline, dar un peroxid important, peroxidul de hidrogen (H2O2), nu a fost încă discutat.
H2O2 poate fi preparat prin electroliza soluțiilor care conțin ioni de sulfat. H2O2 este un acid slab și poate servi ca agent oxidant (oxigenul fiind redus la starea -2) sau ca agent reducător (oxigenul fiind oxidat la starea 0). Ca și ionul peroxid, molecula de H2O2 conține o legătură simplă O-O. Această legătură este destul de slabă în comparație cu multe alte legături simple, iar acest lucru contribuie la reactivitatea H2O2. Compusul se descompune ușor, mai ales dacă este expus la lumină sau contaminat cu urme de metale de tranziție. Descompunerea
\poate avea loc în mod exploziv în cazul lichidului pur.Sulf Deși acest element este doar al șaisprezecelea ca abundență la suprafața pământului, este unul dintre puținele care a fost cunoscut și utilizat de-a lungul istoriei. Depozitele de sulf elementar nu sunt neobișnuite și, pentru că erau pietre care ardeau, au fost denumite inițial „brimstone”. Arderea sulfului produce dioxid de sulf,
\
Acest gaz incolor are un miros sufocant și este mai otrăvitor decât monoxidul de carbon. Este anhidrida acidului sulfuros, un acid diprotic slab:
\
SO2 este, de asemenea, produs atunci când aproape orice substanță care conține sulf este arsă în aer. Cărbunele, de exemplu, conține de obicei între 1 și 4% sulf, astfel că arderea cărbunelui eliberează SO2 în atmosferă. Multe minereuri metalice sunt sulfuri, iar atunci când acestea sunt încălzite în aer, se produce SO2. Cuprul, de exemplu, poate fi obținut sub formă de element prin încălzirea sulfurii de cupru(I):
\
Din moment ce SO2 este atât de otrăvitor, eliberarea sa în atmosferă este o problemă majoră de poluare. Odată ajuns în aer, SO2 se oxidează lent în trioxid de sulf, SO3:
Acest compus este anhidrida acidului sulfuric, H2SO4:
De aceea, dacă aerul este poluat cu SO2 și SO3, se poate forma o ceață fină de picături diluate de. Toate cele trei substanțe sunt foarte iritante pentru gât și plămâni și sunt responsabile de daune considerabile pentru sănătatea umană.
Mecanismul natural de eliminare a oxizilor de sulf din aer este dizolvarea în picături de ploaie, urmată de precipitații. Acest lucru face ca apa de ploaie să fie mai acidă decât ar fi altfel, iar ploaia acidă este acum comună în zonele industrializate din Statele Unite și Europa. Ploaia acidă poate dizolva lent calcarul și marmura, ambele formate din CaCO3:
\
De aceea, statuile și clădirile realizate din aceste materiale pot fi deteriorate.
În ciuda faptului că o cantitate imensă de sulf este eliberată în mediu prin arderea cărbunelui și topirea minereurilor, acest element nu este de obicei recuperat din astfel de procese. În schimb, este obținut în scop comercial din depozite mari de-a lungul coastei americane a Golfului și din rafinarea petrolului acru. Petrolul acru conține numeroși compuși ai sulfului, inclusiv H2S, care miroase a ouă stricate. Zăcămintele de sulf elementar din Texas și Louisiana sunt exploatate prin procedeul Frasch. Apa la 170°C este pompată pe o conductă pentru a topi sulful, iar acesta din urmă este forțat la suprafață prin aer comprimat. Cea mai mare parte a H2S sau S8 obținut din aceste surse este oxidat în SO2, trecut peste un catalizator de vanadiu pentru a obține SO3 și dizolvat în apă pentru a obține H2SO4. În 2005, în lume s-au produs aproximativ 190 de miliarde de kg de H2SO4, ceea ce face ca H2SO4 să fie una dintre cele mai importante substanțe chimice industriale. Aproximativ jumătate din el este utilizat în producția de îngrășăminte fosfatice.
H2SO4 pur este un lichid la temperatura camerei și are o mare afinitate pentru H2O. Acest lucru se datorează, aparent, reacției
\
Formația de H3O+ eliberează energie, iar reacția este exotermă. H2SO4 concentrat are 93% H2SO4 și 7% H2O ca masă, ceea ce corespunde la mai mult de două ori mai multe molecule de H2SO4 decât de H2O. Deoarece multe molecule de H2SO4 mai au încă protoni de donat, H2SO4 concentrat are, de asemenea, o mare afinitate pentru H2O. Este adesea folosit ca agent de uscare și poate fi utilizat în reacții de condensare care dau H2O.
- „Montreal Protocol-One Page Factsheet”. Agenția pentru Protecția Mediului. 6 septembrie 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. „Statement on Health Effects of Air Pollution before the Senate Committee on Health, Education, Labor and Pensions, Subcommittee on Health”. Departamentul de Sănătate și Servicii Umane. 3 septembrie 2003. www.hhs.gov/asl/testify/t020903.html
- Bala Suresh și Yoshio Inoguchi. „Sulfuric Acid”. SRI Consulting. Iulie 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Contribuitori
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff și Adam Hahn.
.