När vi närmar oss den högra sidan av det periodiska systemet blir likheterna mellan grundämnena inom en grupp större igen. Detta gäller för grupp VIA. Med undantag för polonium, som är radioaktivt och vanligtvis utelämnas från diskussionen, bildar alla medlemmar i gruppen X2-joner när de kombineras med starkt elektropositiva metaller. Benägenheten att reduceras till oxidationstillstånd -2 minskar dock betydligt från toppen till botten av gruppen, och tellur uppvisar vissa metalliska egenskaper. Elementen i grupp VIA kallas chalkogener eftersom de flesta malmer av koppar (grekisk chalkos) är oxider eller sulfider, och sådana malmer innehåller spår av selen och tellur. Atomära egenskaper hos chalkogenerna sammanfattas i tabellen.
| Element | Symbol | Elektronkonfiguration | Usual Oxidation State | Radius/pm | ||
|---|---|---|---|---|---|---|
| Kovalent | Ioniskt (X2-) | |||||
| Oxygen | O | 2s22p4 | -2 | 66 | 140 | |
| Sulfur | S | 3s23p4 | +6, +4, -2 | 104 | 184 | |
| Selen | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 | |
| Tellurium | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 | |
| Symbol | Ioniseringsenergi/MJ mol-1 | Densitet/ g cm-3 | Elektro- negativitet | Smältpunkt (i °C) | |||
|---|---|---|---|---|---|---|---|
| Första | Den andra | Den tredje | |||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 | |
| S | 1.006 | 2.257 | 3.367 | 2.06 | 2.5 | 119 | |
| Se | 0.947 | 2.051 | 2.980 | 4.82 | 2.4 | 217 | |
| Te | 0.876 | 1.800 | 2.704 | 6,25 | 2,1 | 450 | |
Vid vanliga temperaturer och tryck är syre en gas. Det existerar i någon av två allotropa former: O2, som utgör 21 procent av jordens atmosfär, eller O3 (ozon), som långsamt bryts ned till O2. O3 kan framställas genom att en elektrisk urladdning passerar genom O2 eller luft:
\
Denna reaktion sker naturligt som ett resultat av blixtnedslag. O3 framställs också av alla anordningar som producerar elektriska gnistor. Du kanske har lagt märke till dess distinkta lukt i närheten av till exempel en elmotor.
Ozon bildas i jordens stratosfär (mellan 10 och 50 km höjd) av ultravioletta strålar vars våglängd är kortare än 250 nm:
Ozonet i sig självt absorberar ultraviolett strålning med längre våglängder (upp till 340 nm), vilket gör att dessa skadliga strålar inte når jordytan. Annars skulle dessa strålar öka förekomsten av hudcancer hos människor och orsaka andra miljöproblem. På senare år har man fått övertygande bevis för att kväveoxidutsläpp från flygplan med överljudsflyg (som flyger i stratosfären) kan minska ozonkoncentrationen. Liknande slutsatser har dragits när det gäller klorfluorkarboner (ibland kallade CFC) som används som drivmedel i aerosolhårsprayer och deodoranter. När CFC-ämnena väl finns i atmosfären bryts atomärt klor av från CFC genom en fotokemisk reaktion. Detta atomära klor kan sedan delta i en katalytisk ozonnedbrytande reaktion:
\
Atomärt klor återskapas, vilket innebär att varje CFC-molekyl har potential att bryta ned stora mängder ozon. På 1980-talet konstaterades det att användningen av kemikalier som CFC:er tunnade ut stratosfäriskt ozon. Det var också då man upptäckte ”ozonhålet” över Antarktis. Som ett svar på nedbrytningen av ozon och den fara som den innebar undertecknades Montrealprotokollet om ämnen som bryter ned ozonskiktet av ledare från flera länder, med målet att fasa ut produktion och användning av CFC och andra kemikalier som är skadliga för ozonskiktet. I dag har 191 länder undertecknat protokollet, och även om det beräknas ta fram till 2075 innan ozonnivåerna återgår till det normala, har Montrealprotokollet hittills visat sig vara en framgång.
O3 är också en viktig komponent i fotokemisk smog. Det bildas när O-atomer (som bildas genom att bryta N-O-bindningar i NO2) reagerar med molekyler enligt Eq. \(\ref{3}\). O3 är ett starkare oxidationsmedel än O2. Det reagerar med omättade kolväten (alkener) i förångad bensin och bildar aldehyder och ketoner som är ögonirriterande. Gummi är ett polymermaterial som innehåller 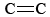 -bindningar och reagerar därför också med O3. Dessutom har marknära ozon och den smog som följer med det visat sig vara ett betydande hälsoproblem, eftersom det irriterar och skadar andningsorganen och även har kopplingar till astma. Ozon är alltså fördelaktigt när det befinner sig i den övre atmosfären, men har negativa effekter när det befinner sig på marknivå.
-bindningar och reagerar därför också med O3. Dessutom har marknära ozon och den smog som följer med det visat sig vara ett betydande hälsoproblem, eftersom det irriterar och skadar andningsorganen och även har kopplingar till astma. Ozon är alltså fördelaktigt när det befinner sig i den övre atmosfären, men har negativa effekter när det befinner sig på marknivå.
Svavel förekommer i en mängd olika allotropa former. Vid rumstemperatur är den mest stabila formen rombiskt svavel. Detta gula fasta ämne består av S8-molekyler (ses i Jmol nedan) packade i ett kristallgitter som tillhör det ortorhombiska systemet (listat på sidan som diskuterar kristallsystem).
Figur \(\PageIndex{1}\) S8-molekyl: Den ursprungliga modellen med boll och pinne kan manipuleras i det tredimensionella rummet. Klicka på VdW-radierna för att se en rumsfyllande modell av samma molekyl.
När den upphettas till 96 °C förändras fast rombiskt svavel mycket långsamt till monoklint svavel, där en tredjedel av S8-molekylerna är slumpmässigt orienterade i kristallgitteret. När båda formerna av svavel smälter är vätskan först blekgul och flyter lätt, men över 160°C blir den alltmer viskös. Det är först nära kokpunkten på 444,6 °C som den blir tunnflytande igen. Denna ovanliga förändring av viskositeten med temperaturen tillskrivs öppnandet av den åttadelade ringen i S8 och bildandet av långa kedjor av svavelatomer. Dessa är sammanflätade och hindrar vätskan från att flyta. Denna förklaring stöds av det faktum att om den viskösa vätskan kyls snabbt genom att hälla den i vatten, kan man experimentellt visa att det amorfa svavel som bildas består av långa kedjor av svavelatomer.
Både selen och tellur har fasta strukturer där atomerna är bundna i långa spiralformade kedjor. Båda är halvledare, och den elektriska ledningsförmågan hos selen beror på intensiteten av det ljus som faller på grundämnet. Denna egenskap utnyttjas i fotoceller av selen, som ofta används i fotografiska exponeringsmätare.
Selen används också i likriktare för att omvandla elektrisk växelström till likström. Föreningar av selen och tellur har liten kommersiell betydelse och är ofta giftiga. Dessutom har många av dem en illaluktande lukt, tas upp av kroppen och avges med svett och i andedräkten. Dessa egenskaper har hindrat studier av tellur- och selenföreningar.
Kemiska reaktioner och föreningar
Syra Eftersom syre har den näst största elektronegativiteten bland alla grundämnen återfinns det i oxidationstillstånd -2 i de flesta föreningar. Viktiga oxider har redan diskuterats i de avsnitt som behandlar de grundämnen från vilka de bildas, och vi kommer därför endast att behandla ovanliga oxidationstillstånd för syre här. Ett av dessa är det +2-tillstånd som finns i OF2, den vanligaste föreningen där syre är kombinerat med det mer elektronegativa fluor. Vi har redan nämnt de -½- och -1-tillstånd som observeras i superoxider och peroxider av alkalimetaller, men en viktig peroxid, väteperoxid (H2O2), har ännu inte diskuterats.
H2O2 kan framställas genom elektrolys av lösningar som innehåller sulfatjoner. H2O2 är en svag syra och kan fungera som oxidationsmedel (syre reduceras till -2-tillståndet) eller som reduktionsmedel (syre oxideras till 0-tillståndet). Liksom peroxidjonen innehåller H2O2-molekylen en O-O enkelbindning. Denna bindning är ganska svag jämfört med många andra enkelbindningar, och detta bidrar till H2O2:s reaktivitet. Föreningen sönderdelas lätt, särskilt om den utsätts för ljus eller kontamineras med spår av övergångsmetaller. Nedbrytningen
\kan ske explosivt i fallet med den rena vätskan. svavel Även om detta grundämne endast förekommer till sextonde plats på jordens yta är det ett av de få som har varit känt och använts under historiens gång. Avlagringar av elementärt svavel är inte ovanliga, och eftersom de var stenar som skulle brinna kallades de ursprungligen för svavelsten. Vid förbränning av svavel bildas svaveldioxid,
\
Denna färglösa gas har en kvävande lukt och är giftigare än kolmonoxid. Den är anhydrid av svavelsyra, en svag diprotisk syra:
\
SO2 bildas också när nästan alla svavelhaltiga ämnen förbränns i luft. Kol innehåller till exempel vanligtvis 1 till 4 % svavel, och vid förbränning av kol släpps SO2 ut i atmosfären. Många metallmalmer är sulfider, och när de upphettas i luft bildas SO2. Koppar kan till exempel erhållas som grundämne genom upphettning av koppar(I)sulfid:
\
Då SO2 är så giftigt är dess utsläpp till atmosfären ett stort föroreningsproblem. När SO2 väl finns i luften oxideras det långsamt till svaveltrioxid, SO3:
Denna förening är anhydrid av svavelsyra, H2SO4:
\
Därmed kan det bildas en fin dimma av utspädda droppar av SO2 och SO3 om luften förorenas med SO2 och SO3. Alla tre ämnena är mycket irriterande för hals och lungor och orsakar betydande skador på människors hälsa.
Den naturliga mekanismen för att avlägsna svaveloxider från luften är lösning i regndroppar, följt av nederbörd. Detta gör regnvattnet surare än det annars skulle vara, och surt regn är numera vanligt i industrialiserade områden i USA och Europa. Surt regn kan långsamt lösa upp kalksten och marmor, som båda består av CaCO3:
\
Därigenom kan statyer och byggnader som är gjorda av dessa material skadas.
Trots att en enorm mängd svavel släpps ut i miljön vid förbränning av kol och smältning av malm, återvinns detta grundämne vanligen inte från sådana processer. Istället erhålls det kommersiellt från stora fyndigheter längs den amerikanska golfkusten och från raffinering av sura oljor. Sour petroleum innehåller många svavelföreningar, bland annat H2S, som luktar som ruttna ägg. Fyndigheterna av elementärt svavel i Texas och Louisiana bryts genom Frasch-processen. Vatten vid 170 °C pumpas ner i ett rör för att smälta svaveln, som sedan pressas upp till ytan med hjälp av tryckluft. Det mesta av det H2S eller S8 som erhålls från dessa källor oxideras till SO2, passerar över en vanadiumkatalysator för att göra SO3 och löses upp i vatten för att göra H2SO4. År 2005 producerades uppskattningsvis 190 miljarder kg H2SO4 i världen, vilket gör H2SO4 till en av de viktigaste industrikemikalierna. Ungefär hälften av den används vid produktion av fosfatgödsel.
Ren H2SO4 är en vätska vid rumstemperatur och har en stor affinitet för H2O. Detta beror uppenbarligen på reaktionen
\
Formationen av H3O+ frigör energi och reaktionen är exoterm. Koncentrerad H2SO4 består av 93 % H2SO4 och 7 % H2O i massa, vilket motsvarar mer än dubbelt så många H2SO4- som H2O-molekyler. Eftersom många H2SO4-molekyler fortfarande har protoner att avge har koncentrerat H2SO4 också en stor affinitet för H2O. Det används ofta som torkmedel och kan användas i kondensationsreaktioner som ger upphov till H2O.
- ”Montreal Protocol-One Page Factsheet”. Environmental Protection Agency. 6 september 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. ”Statement on Health Effects of Air Pollution before the Senate Committee on Health, Education, Labor and Pensions, Subcommittee on Health”. Department of Health and Human Services. 3 september 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh och Yoshio Inoguchi. ”Svavelsyra”. SRI Consulting. Juli 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Medarbetare
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff och Adam Hahn.
.