Jak se blížíme k pravé straně periodické tabulky, podobnosti mezi prvky v rámci skupiny se opět zvyšují. To platí i pro skupinu VIA. Kromě polonia, které je radioaktivní a obvykle se v diskusi vynechává, tvoří všichni členové skupiny v kombinaci s vysoce elektropozitivními kovy ionty X2-. Tendence k redukci do oxidačního stavu -2 však výrazně klesá od horní části skupiny směrem dolů a tellur vykazuje některé kovové vlastnosti. Prvky skupiny VIA se nazývají chalkogeny, protože většina rud mědi (řecky chalkos) jsou oxidy nebo sulfidy a takové rudy obsahují stopy selenu a telluru. Atomové vlastnosti chalkogenů jsou shrnuty v tabulce.
| Prvek | Symbol | Elektronová konfigurace | Určitá oxidace. Stav | Radius/pm | |
|---|---|---|---|---|---|
| kovalentní | iontový (X2-) | ||||
| Kyslík | O | 2s22p4 | -2 | 66 | 140 |
| Síra | S | 3s23p4 | +6, +4, -2 | 104 | 184 |
| Selen | Se | 4s23d104p4 | +6, +4, -2 | 117 | 198 |
| Telur | Te | 5s24d105p4 | +6, +4, -2 | 135 | 221 |
| Symbol | Ionizační energie/MJ mol-1 | Hustota/ g cm-3 | Elektro- negativita | Teplota tání (ve °C) | ||
|---|---|---|---|---|---|---|
| První | Druhý | Třetí | ||||
| O | 1.320 | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 |
| S | 1.006 | 2,257 | 3,367 | 2,06 | 2,5 | 119 |
| Se | 0,947 | 2.051 | 2,980 | 4,82 | 2,4 | 217 |
| Te | 0,876 | 1,800 | 2.704 | 6,25 | 2,1 | 450 |
Při běžných teplotách a tlacích je kyslík plyn. Existuje v jedné ze dvou alotropických forem: O2, který tvoří 21 % zemské atmosféry, nebo O3 (ozon), který se pomalu rozkládá na O2. O3 lze připravit průchodem elektrického výboje přes O2 nebo vzduch:
\
Tato reakce probíhá přirozeně v důsledku blesků. O3 vzniká také v jakémkoli zařízení, které vytváří elektrické jiskry. Možná jste si všimli jeho charakteristického zápachu například v blízkosti elektromotoru.
Ozon vzniká v zemské stratosféře (ve výškách mezi 10 a. 50 km) působením ultrafialového záření, jehož vlnová délka je kratší než 250 nm:
\
\
Ozon sám o sobě pohlcuje ultrafialové záření s delší vlnovou délkou (až 340 nm) a zabraňuje tak pronikání těchto škodlivých paprsků na zemský povrch. V opačném případě by tyto paprsky zvyšovaly výskyt rakoviny lidské kůže a způsobovaly další ekologické problémy. V posledních letech byly získány přesvědčivé důkazy o tom, že emise oxidů dusíku z nadzvukových dopravních letadel (která létají ve stratosféře) mohou snižovat koncentraci ozonu. Podobné závěry byly učiněny i v případě chlorofluorouhlovodíků (někdy označovaných jako CFC) používaných jako hnací plyn v aerosolových lacích na vlasy a deodorantech. Po vstupu do atmosféry dochází fotochemickou reakcí k odštěpení atomárního chloru z freonů. Tento atomární chlor se pak může účastnit katalytické reakce poškozující ozon:
\
\
Atomární chlor se regeneruje, což znamená, že každá molekula CFC má potenciál poškozovat velké množství ozonu. V 80. letech 20. století bylo zjištěno, že používání chemických látek, jako jsou freony, ztenčuje stratosférický ozón. Tehdy byla také objevena „ozónová díra“ nad Antarktidou. V reakci na úbytek ozonu a s tím spojené nebezpečí podepsali představitelé mnoha zemí Montrealský protokol o látkách, které poškozují ozonovou vrstvu, jehož cílem bylo postupně ukončit výrobu a používání freonů a dalších chemických látek poškozujících ozonovou vrstvu. Dnes protokol podepsalo 191 zemí, a přestože se předpokládá, že návrat k normálním hodnotám ozonu potrvá až do roku 2075, Montrealský protokol je zatím úspěšný.
O3 je také důležitou složkou fotochemického smogu. Vzniká při reakci atomů O (vznikajících rozpadem vazeb N-O v NO2) s molekulami podle rov. \(\ref{3}\). O3 je silnější oxidační činidlo než O2. Reaguje s nenasycenými uhlovodíky (alkeny) v odpařeném benzinu za vzniku aldehydů a ketonů, které dráždí oči. Kaučuk je polymerní materiál, který obsahuje 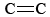 vazby, a proto také reaguje s O3. Dále se ukázalo, že přízemní ozón a s ním spojený smog je významným zdravotním problémem, protože dráždí a poškozuje dýchací systém a má také souvislost s astmatem. Ozon je tedy ve vyšších vrstvách atmosféry prospěšný, ale při zemi má nepříznivé účinky.
vazby, a proto také reaguje s O3. Dále se ukázalo, že přízemní ozón a s ním spojený smog je významným zdravotním problémem, protože dráždí a poškozuje dýchací systém a má také souvislost s astmatem. Ozon je tedy ve vyšších vrstvách atmosféry prospěšný, ale při zemi má nepříznivé účinky.
Síra se vyskytuje v různých alotropických formách. Při pokojové teplotě je nejstabilnější formou kosočtverečná síra. Tato žlutá pevná látka se skládá z molekul S8 (viz Jmol níže) zabalených v krystalové mřížce, která patří do ortorhombické soustavy (uvedené na stránce pojednávající o krystalových soustavách).
Obrázek \(\PageIndex{1}\) Molekula S8: S výchozím modelem koule a tyčinky lze manipulovat v trojrozměrném prostoru. Kliknutím na poloměry VdW zobrazíte model stejné molekuly vyplňující prostor.
Při zahřátí na 96 °C se pevná kosočtverečná síra velmi pomalu mění na síru monoklinickou, v níž je třetina molekul S8 náhodně orientována v krystalové mřížce. Při tání obou forem síry je kapalina zpočátku světle žlutá a snadno teče, ale při teplotě nad 160 °C se stává stále viskóznější. Teprve v blízkosti bodu varu 444,6 °C se opět zředí. Tato neobvyklá změna viskozity s teplotou se připisuje otevření osmičlenného kruhu S8 a vzniku dlouhých řetězců atomů síry. Ty se vzájemně proplétají a brání toku kapaliny. Toto vysvětlení podporuje skutečnost, že pokud se viskózní kapalina rychle ochladí nalitím do vody, lze experimentálně prokázat, že vzniklá amorfní síra se skládá z dlouhých řetězců atomů síry.
Selen i tellur mají pevné struktury, v nichž jsou atomy vázány v dlouhých spirálovitých řetězcích. Oba jsou polovodiče a elektrická vodivost selenu závisí na intenzitě světla dopadajícího na prvek. Této vlastnosti se využívá v selenových fotočláncích, které se často používají ve fotografických expozimetrech.
Selen se také používá v usměrňovačích k přeměně střídavého elektrického proudu na stejnosměrný. Sloučeniny selenu a telluru mají malý komerční význam a často jsou toxické. Mnohé z nich navíc nepříjemně zapáchají, tělo je přijímá a vylučují se potem a dechem. Tyto vlastnosti brání studiu sloučenin telluru a selenu.
Chemické reakce a sloučeniny
Kyslík Vzhledem k tomu, že kyslík má druhou největší elektronegativitu ze všech prvků, nachází se ve většině sloučenin v oxidačním stavu -2. Kyslík je ve většině sloučenin v oxidačním stavu -2. Důležité oxidy již byly probrány v částech zabývajících se prvky, z nichž vznikají, a proto se zde budeme zabývat pouze neobvyklými oxidačními stavy kyslíku. Jedním z nich je stav +2, který se nachází v OF2, nejběžnější sloučenině, v níž je kyslík kombinován s elektronegativnějším fluorem. Již jsme se zmínili o stavech -½ a -1 pozorovaných v superoxidech a peroxidech alkalických kovů, ale o jednom důležitém peroxidu, peroxidu vodíku (H2O2), jsme se dosud nezmínili.
H2O2 lze připravit elektrolýzou roztoků obsahujících síranové ionty. H2O2 je slabá kyselina a může sloužit jako oxidační činidlo (kyslík se redukuje do stavu -2) nebo jako redukční činidlo (kyslík se oxiduje do stavu 0). Stejně jako peroxidový ion obsahuje molekula H2O2 jednoduchou vazbu O-O. Tato vazba je ve srovnání s mnoha jinými jednoduchými vazbami poměrně slabá, což přispívá k reaktivitě H2O2. Sloučenina se snadno rozkládá, zejména pokud je vystavena světlu nebo kontaminována stopami přechodných kovů. Rozklad
může v případě čisté kapaliny probíhat explozivně. síra Přestože je tento prvek na zemském povrchu zastoupen pouze šestnáctinásobně, je jedním z mála, který byl v historii znám a používán. Ložiska elementární síry nejsou neobvyklá, a protože se jednalo o kameny, které hořely, nazývaly se původně síra. Při hoření síry vzniká oxid siřičitý,
\
tento bezbarvý plyn má dusivý zápach a je jedovatější než oxid uhelnatý. Je to anhydrid kyseliny sírové, slabé kyseliny diprotické:
\
SO2 vzniká také při spalování téměř jakékoli látky obsahující síru na vzduchu. Například uhlí obvykle obsahuje 1 až 4 % síry, a proto se při jeho spalování uvolňuje SO2 do atmosféry. Mnoho kovových rud jsou sulfidy a při jejich zahřívání na vzduchu vzniká SO2. Například měď lze získat jako prvek zahříváním sulfidu mědi(I):
\
Protože je SO2 tak jedovatý, je jeho uvolňování do atmosféry velkým problémem znečištění. Jakmile se SO2 dostane do ovzduší, pomalu se oxiduje na oxid sírový, SO3:
\
Tato sloučenina je anhydridem kyseliny sírové, H2SO4:
\
Pokud je ovzduší znečištěno SO2 a SO3, může se vytvořit jemná mlha zředěných kapiček. Všechny tři látky velmi dráždí hrdlo a plíce a jsou zodpovědné za značné poškození lidského zdraví.
Přirozeným mechanismem odstraňování oxidů síry ze vzduchu je rozpuštění v dešťových kapkách a následné vysrážení. Tím se dešťová voda stává kyselejší, než by jinak byla, a kyselé deště jsou dnes běžné v průmyslově vyspělých oblastech Spojených států a Evropy. Kyselý déšť může pomalu rozpouštět vápenec a mramor, které se skládají z CaCO3:
\
Tak mohou být poškozeny sochy a stavby z těchto materiálů.
Přestože se při spalování uhlí a tavení rud uvolňuje do životního prostředí obrovské množství síry, tento prvek se z těchto procesů obvykle nezískává. Místo toho se komerčně získává z velkých ložisek na pobřeží Mexického zálivu v USA a při rafinaci kyselé ropy. Kyselá ropa obsahuje řadu sloučenin síry, včetně H2S, který je cítit po zkažených vejcích. Ložiska elementární síry v Texasu a Louisianě se těží Fraschovým postupem. Voda o teplotě 170 °C se čerpá potrubím, aby se síra roztavila, a stlačeným vzduchem se vytlačí na povrch. Většina H2S nebo S8 získaná z těchto zdrojů se oxiduje na SO2, přechází přes vanadový katalyzátor na SO3 a rozpouští se ve vodě na H2SO4. V roce 2005 se ve světě vyrobilo odhadem 190 miliard kg H2SO4, což z něj činí jednu z nejdůležitějších průmyslových chemikálií. Přibližně polovina se používá při výrobě fosfátových hnojiv.
Čistý H2SO4 je při pokojové teplotě kapalný a má velkou afinitu k H2O. To je zřejmě způsobeno reakcí
\
Při vzniku H3O+ se uvolňuje energie a reakce je exotermická. Koncentrovaný H2SO4 tvoří 93 % hmotnosti H2SO4 a 7 % hmotnosti H2O, což odpovídá více než dvojnásobnému počtu molekul H2SO4 než H2O. Protože mnoho molekul H2SO4 má ještě protony, které může darovat, má koncentrovaný H2SO4 také velkou afinitu k H2O. Často se používá jako sušící činidlo a lze jej použít při kondenzačních reakcích, při nichž vzniká H2O.
- „Montrealský protokol – jednostránkový informační přehled“. Agentura pro ochranu životního prostředí. 6. září 2007. http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. „Prohlášení o zdravotních účincích znečištění ovzduší před senátním výborem pro zdravotnictví, vzdělávání, práci a důchody, podvýborem pro zdraví“. Ministerstvo zdravotnictví a sociálních služeb. 3. září 2003. www.hhs.gov/asl/testify/t020903.html
- Bala Suresh a Yoshio Inoguchi. „Kyselina sírová“. SRI Consulting. Červenec 2006. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
Přispěvatelé
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff a Adam Hahn.
.