周期表の右側に近づくと、グループ内の元素の類似性が再び大きくなってきます。 VIA族がそうである。 ポロニウムは放射性であり、通常議論から省かれているが、このグループのすべてのメンバーは、電気的陽性の高い金属と結合するとX2-イオンを形成する。 しかし、-2酸化状態に還元される傾向は、グループの上から下へと著しく減少し、テルルはいくつかの金属的性質を示す。 VIA族元素がカルコゲンと呼ばれるのは、銅(ギリシャ語のchalkos)の鉱石のほとんどが酸化物または硫化物であり、そのような鉱石にセレンやテルルが微量に含まれているためである。 カルコゲンの原子特性は表にまとめてあります。 VIA族元素の性質
+6, +4, -2
| 記号 | イオン化エネルギー/MJ mol-1 | 密度/g cm-3 | 融点(単位:℃) | ||||
|---|---|---|---|---|---|---|---|
| セカンド | O | 3.395 | 5.307 | 1.43×10-3 | 3.5 | -218 | |
| S | 1.006 | 2.257 | 3.367 | 2.06 | 2.5 | ||
| SE | 0.947 | 2.0 | 2.980 | 4.82 | 2.4 | 217 | |
| Te | 0.876 | 1.800 | 2.0 | ||||
| Te | 0.760 | 2.040 | 2.040 | 1.040 | 6.25 | 2.1 | 450 |
通常の温度と圧力では、酸素は気体であります。 酸素は2つの同位体のどちらかで存在します。 地球の大気の21パーセントを占めるO2と、ゆっくりと分解してO2になるO3(オゾン)です。 O3は、O2や空気に放電を通すことで生成される。
この反応は、雷が落ちることで自然に起こる。 O3はまた、電気火花を発生させるあらゆる装置によって生成される。 オゾンは地球の成層圏(高度10~50km)で、波長が250nmより短い紫外線によって生成されます。 そうでなければ、人間の皮膚がんを増加させるなど、環境問題を引き起こすことになる。 近年、成層圏を飛行する超音速機から排出される窒素酸化物がオゾン濃度を低下させるという有力な証拠が得られている。 また、エアゾール式のヘアスプレーや消臭剤に使用されるフロン(CFC)についても、同様の結論が得られています。 大気中に放出されたフロンは、光化学反応により原子状塩素が分解される。 この原子状塩素が、オゾンを破壊する触媒反応に関与する。
Atomic chlorine is regenerated, which means each CFC molecules has a potential to depleting large amounts of ozone. 1980年代、フロンなどの化学物質の使用により、成層圏のオゾンが減少していることが判明しました。 南極上空に「オゾンホール」が発見されたのもこの頃です。 オゾン層破壊の危機を受け、オゾン層に有害なフロンなどの化学物質の生産と使用を段階的に停止することを目的とした「オゾン層を破壊する物質に関するモントリオール議定書」が複数の国の首脳によって署名されました。 現在、191カ国が議定書に署名し、オゾンレベルが正常に戻るには2075年までかかると予測されていますが、モントリオール議定書は今のところ成功を収めています。 O3は、O原子(NO2のN-O結合を切断して生成)と分子とが式(1)に従って反応することにより生成される。 \の式で表される分子と反応して生成される。 O3はO2よりも強い酸化剤である。 蒸発したガソリン中の不飽和炭化水素(アルケン)と反応し、アルデヒドやケトンを生成し、目を刺激する。 ゴムは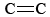 結合を持つ高分子物質なので、これもO3と反応する。 さらに、地上レベルのオゾンとそれに伴うスモッグは、呼吸器系を刺激してダメージを与え、喘息との関連も指摘されるなど、健康への重大な懸念があることが証明されている。 オゾンは上層大気中にあるときは有益ですが、地上にあるときは悪影響を及ぼすのです。 室温で最も安定な形態はひし形硫黄である。 この黄色い固体は斜方晶系(結晶系のページに記載)に属する結晶格子の中にS8分子(下のJmolに見られる)が詰まっている。 初期状態の球と棒のモデルを3次元空間で操作することができます。 VdW radiiをクリックすると同じ分子の空間充填モデルが見られます。
結合を持つ高分子物質なので、これもO3と反応する。 さらに、地上レベルのオゾンとそれに伴うスモッグは、呼吸器系を刺激してダメージを与え、喘息との関連も指摘されるなど、健康への重大な懸念があることが証明されている。 オゾンは上層大気中にあるときは有益ですが、地上にあるときは悪影響を及ぼすのです。 室温で最も安定な形態はひし形硫黄である。 この黄色い固体は斜方晶系(結晶系のページに記載)に属する結晶格子の中にS8分子(下のJmolに見られる)が詰まっている。 初期状態の球と棒のモデルを3次元空間で操作することができます。 VdW radiiをクリックすると同じ分子の空間充填モデルが見られます。
固体の菱形硫黄は96℃に加熱すると非常にゆっくりと変化して、S8分子の1/3が結晶格子の中でランダムに配向した単斜硫黄となります。 いずれの形態の硫黄も融解すると、最初は淡黄色で容易に流動するが、160℃を超えると次第に粘性を帯びるようになる。 沸点444.6℃付近で初めて、再び薄くなる。 この温度による粘性の異常な変化は、S8の8員環が開いて、硫黄原子の長い鎖が形成されたためである。 これが絡み合って、液体が流れるのを邪魔しているのだ。 この説明は、粘性のある液体を水に注いで急速に冷やすと、生成した非晶質硫黄が長い硫黄原子の鎖で構成されていることが実験的に示されたことからも裏付けられている
。 どちらも半導体であり、セレンの電気伝導度は元素に降り注ぐ光の強さに依存する。 この性質を利用して、写真の露出計によく使われるセレン光電池があります。
また、交流電気を直流に変換する整流器にも使用されています。 セレンとテルルの化合物は商業的な重要性はほとんどなく、しばしば有毒である。 しかも、その多くは悪臭を放ち、体内に取り込まれ、汗や呼気で放出される。 このような性質が、テルルやセレン化合物の研究を妨げています。
化学反応と化合物
酸素 酸素はすべての元素の中で2番目に大きな電気陰性度を持っているので、ほとんどの化合物で-2酸化状態になっています。 重要な酸化物については、その元となる元素の項ですでに説明しましたので、ここでは酸素の特殊な酸化状態のみを扱います。 酸素と電気陰性度の高いフッ素が結合した最も一般的な化合物であるOF2に見られる+2状態もその1つです。 アルカリ金属の超酸化物や過酸化物に見られる-1/2状態や-1状態についてはすでに述べたが、重要な過酸化物の1つである過酸化水素(H2O2)についてはまだ論じていない。 H2O2は弱酸であり、酸化剤(酸素が-2状態に還元される)または還元剤(酸素が0状態に酸化される)として機能することができる。 過酸化物イオンと同様に、H2O2分子もO-O単結合を持つ。 この結合は他の多くの単結合に比べてかなり弱く、これがH2O2の反応性の一因となっている。 この化合物は、特に光にさらされたり、微量の遷移金属が混入したりすると容易に分解する。 硫黄 地球上に存在する量は16分の1程度だが、歴史の中で知られ、利用されてきた数少ない元素の一つである。 硫黄の鉱床は珍しくなく、燃える石であったため、当初は硫黄石と呼ばれた。 硫黄を燃やすと二酸化硫黄
が発生するが、この無色のガスは息苦しい臭いがして、一酸化炭素より毒性が強い。 これは弱い二塩基酸である亜硫酸の無水物で、
SO2は、ほとんどすべての硫黄含有物質を空気中で燃焼させたときにも生成される。 たとえば石炭は通常1~4%の硫黄を含むので、石炭を燃やすと大気中にSO2が放出される。 金属鉱石の多くは硫化物であり、これを空気中で加熱するとSO2が発生する。 例えば、銅は硫化銅(I)を加熱することで元素として得られる:
SO2は非常に有毒なので、大気への放出は大きな公害問題である。 大気中に放出されたSO2はゆっくりと酸化され、三酸化硫黄SO3:
この化合物は硫酸H2SO4:
の無水物となり、SO2やSO3で空気が汚れると細かい霧状の液滴を形成することができる。 この3つの物質はいずれも喉や肺を非常に刺激し、人体にかなりの損害を与える原因となっている。
大気中の硫黄酸化物を除去する自然なメカニズムは、雨滴での溶解とそれに続く沈殿である。 このため、雨水は通常よりも酸性度が高くなり、酸性雨は現在、アメリカやヨーロッパの工業地帯でよく見られます。 酸性雨は、CaCO3 からなる石灰岩や大理石をゆっくりと溶かすので、これらの材料でできた像や建物が損傷する可能性があります。 その代わり、アメリカのメキシコ湾岸にある大規模な鉱床とサワー石油の精製から商業的に入手することができます。 サワー石油には、卵の腐ったような臭いのするH2Sをはじめ、多くの硫黄化合物が含まれている。 テキサス州とルイジアナ州にある元素状硫黄の鉱床は、フラシュ法という方法で採掘される。 170℃の水をパイプで送り込み、硫黄を溶かし、圧縮空気で硫黄を地上に押し出す。 このようにして得られたH2SやS8のほとんどは、酸化されてSO2となり、バナジウム触媒の上を通過してSO3となり、水に溶解してH2SO4となる。 2005年には、世界で推定1,900億kgのH2SO4が生産され、H2SO4は最も重要な工業薬品の一つとなっている。
純粋なH2SO4は室温で液体であり、H2Oに対して大きな親和性を持っています。 これは、
H3O+ の生成によりエネルギーが放出され、発熱反応となるためと思われる。 濃縮H2SO4は質量比でH2SO4が93%、H2Oが7%で、H2SO4がH2O分子の2倍以上あることになる。 多くのH2SO4分子はまだ供与するプロトンを持っているので、濃縮H2SO4はH2Oに対しても大きな親和性を持っている。 乾燥剤としてよく使われ、H2Oを発生させる凝縮反応に用いることができる。
- “Montreal Protocol-One Page Factsheet”. 環境保護庁. 2007 年 9 月 6 日。 http://www.epa.gov/ozone/downloads/MP20_FactSheet.pdf
- Kenneth Olden. “上院保健・教育・労働・年金委員会、保健小委員会での大気汚染の健康影響に関する声明. Department of Health and Human Services. 3 September 2003.www.hhs.gov/asl/testify/t020903.html
- Bala Suresh, Yoshio Inoguchi. “Sulfuric Acid”. SRIコンサルティング. 2006年7月. http://www.sriconsulting.com/CEH/Pub…orts/781.5000/
寄稿者
-
Ed Vitz (Kutztown University), John W. Moore (UW-Madison), Justin Shorb (Hope College), Xavier Prat-Resina (University of Minnesota Rochester), Tim Wendorff, および Adam Hahn.
.